
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические
|
|
|
|
Хромовый ангидрид. Хромовые кислоты. Соли хромовых кислот.
Хромовый ангидрид — очень сильный окислитель. Реакции его с некоторыми органическими веществами в присутствии серной кислоты протекают со взрывом:
8 СrО3 + 3 СН3СОСН3 + 12 Н2SО4 = 4 Сr2(SО4)з + 9 СО2 + 9 Н2О
Хромовый ангидрид можно получить действием концентрированной серной кислоты на сухие хроматы или дихроматы:
K2CrO4 + H2SO4 = K2SO4 + CrO3 + H2O
K2Cr2O7 + H2SO4 = K2SO4 + 2 CrO3 + H2O
Хромовый ангидрид применяется как окислитель при различных органических синтезах.
Соли щелочных металлов и аммония хромовых кислот хорошо растворимы в воде. Соли других металлов растворяются трудно. Дихромат калия К2Сг2О7, (хромпик) широко применяется как окислитель в лабораторной практике и химической технологии. Действие хроматов и дихроматов как окислителей проявляется в кислой среде:
К2Сг2О7 + 6 FеSO4 + 7 Н2SO4 = К2SО4 + Сr2(SO4)3 + 3 Fе2(SO4)3 +
+ 7 Н2О
При прибавлении раствора железного купороса к раствору дихромата калия оранжевая окраска исчезает и появляется зеленая, обусловленная образованием гидратированных ионов Сг3+.
Бромиды и иодиды окисляются дихроматом калия до свободных галогенов:
К2Сr2О7 + 6 КI + 7 Н2SO4 = Сr2(SO4)3 + 3I2 + 4 К2SO4 + 7 Н2О
При взаимодействии дихромата калия с иодоводородной и бромоводородной кислотами подкислять раствор не требуется, так как необходимую кислотность создают сами восстановители, которые являются сильными кислотами:
К2Сr2О7 + 14 НВr = 2 КВr + 2 СrВr3 + 3 Вr2 + 7 Н2О
Выделяющийся иод или бром маскирует переход оранжевой окраски раствора в зеленую.
В аналитической химии реакция окисления хроматом или дихроатом калия различных ионов используется для их определения. Этот метод анализа называется хроматометрией.
Раствор дихромата калия в концентрированной серной кислоте называется хромовой смесью и используется в лабораторной практике для мытья посуды. Он легко удаляет жир с поверхности стекла, окисляя его образующимся хромовым ангидридом и смывая концентрированной серной кислотой.
Хромовая кислота — кристаллическое вещество красного цвета. Окрашивает раствор в жёлтый цвет. Выделена в свободном состоянии при охлаждении насыщенных водных растворов хромата. Химическая формула H2CrO4.
Свойства
Хромовая кислота — электролит средней силы. Изополихромовые кислоты существуют в водных растворах, окрашенных в красный цвет. Соли хромовой кислоты являются сильными окислителями, ядовиты. В хромовой кислоте степень окисления хрома равна +6. Хром, как и большинство переходных металлов, может существовать в нескольких степенях окисления. Степень окисления +6 самая высокая для хрома; степень окисления +3 является наиболее стабильной, степень окисления +2 также. Реагирует с основными оксидами и гидроксидами натрия и калия, например амфотерные оксиды и гидроксид цинка с гидроксидом алюминияв ее присутствии или в реакции с хромовой кислотой поведут себя как слабые основания. Продукты реакции — вода и хроматы металлов. Хромовой кислоте соответствуют соли — хроматы, изополихромовым кислотам — изополихроматы (также дихроматы, изополисоединения).
Получение[править | править вики-текст]
· 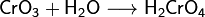
·  При кипении
При кипении
· 
Применение
Растворы хромовой кислоты используют при электролитическом хромировании и получении хрома электролизом. Хромовая кислота является промежуточным веществом при хромировании, а также используется в керамической мураве и в цветных композициях стекла. Поскольку раствор хромовой кислоты в серной (также известная как «сульфохромовая кислота») является мощным окислителем, эта смесь может быть использована для очистки лабораторной посуды, или для растворения нерастворимых органических остатков.
Хромовую кислоту используют для производства:
· металлического хрома высокой чистоты,
· катализаторов,
· электролитического хрома,
· сверхтвердых материалов,
· в производстве литья в составе формовочных и стержневых смесей,
· для процессов хромирования, хроматирования и пассивирования,
· для процессов травления.
Хромовый ангидрид и хромовые кислоты — соединения, в которых хром содержится в высшем валентном состоянии: +6. Триоксид хрома СгО3 — кислотный оксид, который взаимодействует с водой, основными оксидами и основаниями:
· СrО3 + Н2О = Н2СrO4
· 2 СrО3 + Н2О = Н2Сr2О7
· СrО3 + СаО = СаСrО4
· СrО3 + 2 КОН = К2СrО4 + Н2О
· Хромовый ангидрид может образовывать как хромовую, так и двухромовую кислоты и их соли. Состояние равновесия
· 2 СrО42- + 2 Н+U 2 НСrО-U Cr2О72- + Н2О
· зависит от кислотности среды: в кислом растворе основная масса хрома находится в виде дихромата, а в щелочном, где концентрация ионов водорода очень мала, — в виде хромата.
· Хромовый ангидрид — очень сильный окислитель. Реакции его с некоторыми органическими веществами в присутствии серной кислоты протекают со взрывом:
· 8 СrО3 + 3 СН3СОСН3 + 12 Н2SО4 = 4 Сr2(SО4)з + 9 СО2 + 9 Н2О
· Хромовый ангидрид можно получить действием концентрированной серной кислоты на сухие хроматы или дихроматы:
· K2CrO4 + H2SO4 = K2SO4 + CrO3 + H2O
· K2Cr2O7 + H2SO4 = K2SO4 + 2 CrO3 + H2O
· Хромовый ангидрид применяется как окислитель при различных органических синтезах.
· Соли щелочных металлов и аммония хромовых кислот хорошо растворимы в воде. Соли других металлов растворяются трудно. Дихромат калия К2Сг2О7, (хромпик) широко применяется как окислитель в лабораторной практике и химической технологии. Действие хроматов и дихроматов как окислителей проявляется в кислой среде:
· К2Сг2О7 + 6 FеSO4 + 7 Н2SO4 = К2SО4 + Сr2(SO4)3 + 3 Fе2(SO4)3 +
· + 7 Н2О
· При прибавлении раствора железного купороса к раствору дихромата калия оранжевая окраска исчезает и появляется зеленая, обусловленная образованием гидратированных ионов Сг3+.
· Бромиды и иодиды окисляются дихроматом калия до свободных галогенов:
· К2Сr2О7 + 6 КI + 7 Н2SO4 = Сr2(SO4)3 + 3I2 + 4 К2SO4 + 7 Н2О
· При взаимодействии дихромата калия с иодоводородной и бромоводородной кислотами подкислять раствор не требуется, так как необходимую кислотность создают сами восстановители, которые являются сильными кислотами:
· К2Сr2О7 + 14 НВr = 2 КВr + 2 СrВr3 + 3 Вr2 + 7 Н2О
· Выделяющийся иод или бром маскирует переход оранжевой окраски раствора в зеленую.
· В аналитической химии реакция окисления хроматом или дихроатом калия различных ионов используется для их определения. Этот метод анализа называется хроматометрией.
· Раствор дихромата калия в концентрированной серной кислоте называется хромовой смесью и используется в лабораторной практике для мытья посуды. Он легко удаляет жир с поверхности стекла, окисляя его образующимся хромовым ангидридом и смывая концентрированной серной кислотой.
Чистый хром — очень твердый тугоплавкий металл голубовато-серебристого цвета. Имеет самую большую твердость из всех применяемых в промышленности металлов. Т. пл. 1890°С, плотность 7,19 г/см.

При образовании соединений с другими элементами хром может использовать от 1 до 6 валентных электронов. Наибольшую устойчивость и практическую значимость имеют соединения, в которых атомы Сг находятся в степенях окисления +2, +3, +6.
С повышением степени окисления атомов Сг в оксидах и гидроксидах их основный характер ослабевает,а кислотный — усиливается. В этом же направлении происходит замена восстановительной активности на окислительную.

1. Алюминотермический: Сr2O3 + 2Al = Аl2O3 + 2Сr
2. Силикотермический: 2Сr2O3 + 3Si = 3SiO2 + 4Cr
3. Электролитический: 2CrCl3 = 2Сr + 3Cl2
Поверхностная оксидная пленка является причиной инертности хрома при обычной температуре, благодаря чему этот металл не подвергается атмосферной коррозии (в отличие от железа).
При нагревании хром проявляет свойства довольно активного металла, что соответствует его положению в электрохимическом ряду напряжений.


СrO — оксид хрома (II). Твердое черное вещество, н. р. в Н2O.
1) медленное окисление хрома, растворенного в ртути
2Сr + O2 = 2СrO
2) обезвоживание Сr(ОН)2 в восстановительной атмосфере:
Сr(ОН)2 = СrO + H2O
СrO — неустойчивое вещество, легко окисляется при небольшом нагревании до Сr2O3; при более высоких Т диспропорционирует:
3СrО = Сr + Сr2O3
СrO — типичный основный оксид, проявляет характерные для этого класса свойства. Реакции необходимо проводить в восстановительной среде.
Сr(OН)2 — гидроксид хрома (II) твердое желтое вещество, н. р. в Н2O.
Получают обменными реакциями из солей Сr2+:
CrCl2 + 2NaOH = Сr(ОН)2 + 2NaCl
Неустойчивое вещество, разлагается при нагревании; на воздухе быстро окисляется с образованием зеленого гидроксида хрома (III);
4Сr(ОН)2 + O2 + 2Н2O = 4Сr(ОН)3
желтый → зеленый
Наиболее важные: CrCl2, CrSO4, (СН3СОО)2Сr. Гидратированный ион Сr2+ имеет бледно-голубую окраску.
1. Сr + неметалл (S, Hal2)
Сr + 2HCl(r) = CrCl2 + Н2
2. Восстановление солей Сr3+:
2СrСl3 + Н2 = 2CrCl2 + 2HCl
1. Соли Сr2+ — сильные восстановители, так как очень легко окисляются до солей Сr3+
4CrCl2 + 4HCl + O2 = 4СrСl3 + 2Н2О
2. Раствор CrSO4 в разбавленной H2SO4 - превосходный поглотитель кислорода:
4CrSO4 + O2 + 2H2SO4 = 2Cr2(SO4)3 + 2Н2О
3. С аммиаком соли Сr2+ образуют комплексные соли — аммиакаты:
CrCl2 + 6NH3 = [Cr(NH3)6]Cl2
Для Сr2+ характерно образование двойных сульфатов, например: K2Cr(SO4)2• 6Н2O
Сr2О3 — оксид хрома (III), важнейшее природное соединение хрома. Сr2О3, полученный химическими методами, представляет собой темно-зеленый порошок.
1. Синтез из простых веществ:
4Сr + 3O2 = 2Сr2О3
2. Термическое разложение гидроксида хрома (III) или дихромата аммония:
2Сr(ОН)3 = Сr2O3 + 3Н2O
(NH4)2Cr2O7 = Сr2O3 + N2 + 4Н2O
3. Восстановление дихроматов углеродом или серой:
К2Сr2O7 + S = Сr2O3 + K2SO4
Сr2O3 используется для изготовления краски «хромовая зеленая», обладающей термо- и влагоустойчивостью.
Сr2O3 — типичный амфотерный оксид
В порошкообразном виде реагирует с сильными кислотами и сильными щелочами, в кристаллическом виде — химически инертное вещество.
К наиболее практически важным реакциям относятся следующие:
1. Восстановление с целью получения металлического хрома:
Сr2O3 + 2Al = 2Сr + Аl2O3
2. Сплавление с оксидами и карбонатами активных металлов:
Сr2O3 + МgО = Мg(СrO2)2
Сr2O3 + Na2CO3 = 2NaCrO2 + CO2
Образующиеся метахромиты являются производными метахромистой кислоты НСrO2.
3. Получение хлорида хрома (III):
Сr2O3 + ЗС + 3Cl2 = 2СrСl3 + ЗСО
Сr2O3 + ЗССl4 = 2СrСl3 + ЗСОСl2
Образуется в виде синевато-серого осадка при действии щелочей на соли Сr3+:
СrСl3 + 3NaOH = Сr(ОН)3 + 3NaCl
Практически нерастворимый в воде гидроксид может существовать в виде коллоидных растворов.
В твердом состоянии гидроксид хрома (III) имеет переменный состав Сr2O3• nН2O. Теряя молекулу воды, Сr(ОН)3 превращается в метагидроксид СrО(ОН).
>Сr(ОН)3 — амфотерный гидроксид, способный растворяться как в кислотах, так и в щелочах:
Cr(OH)3 + 3HCl = СrСl3 + ЗН2O
Сr(ОН)3 + ЗН+ = Сr3+ + ЗН2O
Сr(ОН)3 + 3NaOH = Na3(Cr(OH)6]
Сr(ОН)3 + ЗОН- = [Cr(OH)6]3-гексагидроксохромитанион
При сплавлении с твердыми щелочами образуются метахромиты:
Сr(ОН)3 + NaOH = NaCrO2 + 2Н2O
Растворением осадка Сr(ОН)3 в кислотах получают нитрат Cr(NO3)3, хлорид СrСl3, сульфат Cr2(SO4)3 и другие соли. В твердом состоянии чаще всего содержат в составе молекул кристаллизационную воду, от количества которой зависит окраска соли.
Самой распространенной является двойная соль КСr(SO4)2• 12H2O - хромокалиевые квасцы (сине-фиолетовые кристаллы).
Хромиты, или хроматы (III) — соли, содержащие Сr3+ в составе аниона. Безводные хромиты получают сплавлением Сr2O3 с оксидами двухвалентных металлов:
Сr2O3 + МеО = Ме(СrO2)2 метахромиты
В водных растворах хромиты существуют в виде гидроксокомплексов.
К наиболее характерным свойствам солей Cr(III) относятся следующие:
1. Осаждение катиона Сг3+ под действием щелочей:
Сr3+ + ЗОН- = Сr(ОН)3
Характерный цвет осадка и его способность растворяться в избытке щелочи используется для отличия ионов Сг3+ от других катионов.
2. Легкая гидролизуемость в водных растворах, обусловливающая сильнокислый характер среды:
Сr3+ + Н2O = СrОН2+ + Н+
Соли Сr (III) с анионами слабых и летучих кислот в водных растворах не существуют; так как подвергаются необратимому гидролизу, например:
Cr2S3 + 6Н2O = 2Сr(ОН)3 + 3H2S
3. Окислительно-восстановительная активность:

4. Способность к образованию комплексных соединений - аммиакатов и аквакомплексов, например:
СrСl3 + 6NH3 = [Cr(NH3)6]Cl3
Кристаллическое вещество темно-красного цвета, очень гигроскопичное, легко растворимое в воде. Основной способ получения:
К2Сr2O7(кр.) + H2SO4 = 2CrO3 + K2SO4 + Н2O
СrО3 — кислотный оксид, активно взаимодействует с водой и щелочами, образуя хромовые кислоты и хроматы.
Хромовый ангидрид — чрезвычайно энергичный окислитель. Например, этанол воспламеняется при соприкосновении с СrO3:
С2Н6ОН + 4СrO3 = 2CO2 + ЗН2O + 2Сr2O3
Продуктом восстановления хромового ангидрида, как правило, является Сr2O3.
При растворении CrO3 в воде образуются 2 кислоты:
CrO3 + Н2O = Н2СrO4 хромовая
2CrO3 + Н2O = Н2Сr2O7 дихромовая
Обе кислоты существуют только в водных растворах. Между ними устанавливается равновесие:
2Н2СrO4 = Н2Сr2O7 + Н2O
Обе кислоты очень сильные, по первой ступени диссоциированы практически полностью:
Н2СrO4 = Н+ + НCrO4-
Н2Сr2O7 = Н+ + НСr2O7-
Хроматы (VI) — соли, содержащие анионы хромовой кислоты CrO42-. Почти все имеют желтую окраску (реже — красную). В воде хорошо растворяются только хроматы щелочных металлов и аммония. Хроматы тяжелых металлов н. р. в Н2O. Наиболее распространены: Na2CrO4, К2CrO4, РЬCrO4 (желтый крон).
1. Сплавление CrO3 с основными оксидами, основаниями:
CrO3 + 2NaOH = Na2CrO4 + Н2O
2. Окисление соединений Cr(III) в присутствии щелочей:
2К3[Сr(ОН)6]+ ЗВr2+ 4КОН = 2К2СrO4 + 6КВr + 8Н2O
3. Сплавление Сr2O3 со щелочами в присутствии окислителя:
Сr2О3 + 4КOН + КClO3 = 2К2СrO4 + KCl + 2Н2O
Хроматы существуют только в разбавленных щелочных растворах, которые имеют желтую окраску, характерную для анионов СrO42-. При подкислении раствора эти анионы превращаются в оранжевые дихромат-анионы:
2СrO42- + 2Н+ = Сr2O72- + Н2O Это равновесие мгновенно сдвигается в ту или иную сторону при изменении рН растворов.
Хроматы — сильные окислители.
При нагревании хроматы тяжелых металлов разлагаются; например:
4Нg2СrO4 = 2Сr2O3 + 8Нg + 5O2
Дихроматы (VI) — соли, содержащие анионы дихромовой кислоты Сr2O72-
В отличие от монохроматов имеют оранжево-красную окраску и обладают значительно лучшей растворимостью в воде. Наиболее важные дихроматы — К2Сr2O7, Na2Cr2O7, (NH4)2Cr2O7.
Их получают из соответствующих хроматов под действием кислот, даже очень слабых, например:
2Na2CrO4 + 2СO2 + Н2O → Na2Cr2O7 + 2NaHCO3
Водные растворы дихроматов имеют кислую среду вследствие устанавливаемого равновесия с хроматанионами (см. выше). Окислительные свойства дихроматов наиболее сильно проявляются в подкисленных растворах:
Сr2O72- + 14Н+ + 6e- = 2Сr3+ + 7Н2O
При добавлении восстановителей к кислым растворам дихроматов окраска резко изменяется от оранжевой до зеленой, характерной для соединений Сг3+.

|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 5796; Нарушение авторских прав?; Мы поможем в написании вашей работы!