
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коннексоны щелевого контакта являются олигомерами трансмембранного белка, несколько раз
|
|
|
|
14-6
Десмосомы связывают промежуточные филаменты соседних клеток; полудесмосомы связывают эти
филаменты с базальной мембраной [4]
Десмосомы представляют собой «точечные» структуры межклеточного контакта, которые, подобно заклепкам, скрепляют клетки в различных тканях, главным образом в эпителиальных (рис. 14-10). Они служат также местами прикрепления промежуточных филаментов (разд.
П.5), образующих структурный каркас цитоплазмы, который противодействует растяжению. Таким образом, промежуточные филаменты соседних клеток объединены при помощи десмосом в непрерывную сеть, пронизывающую всю ткань. Тип промежуточных филаментов, прикрепленных к десмосомам, зависит от типа клеток: в большинстве эпителиальных клеток это кератиновые филаменты, в волокнах сердечной мышцы-
десминовые, а в некоторых клетках, покрывающих поверхность мозга- виментиновые (см. табл. 11-5).
Электронная микроскопия и биохимические исследования показывают, что десмосома состоит из (1) плотной цитоплазматической пластинки, образованной комплексом внутриклеточных белков, ответственных за прикрепления цитоскелета, и (2) трансмембранных линкерных гликопротеинов, которые связаны с пластинкой и взаимодействуют между собой своими внеклеточными доменами, удерживая вместе смежные плазматические мембраны (рис. 14-11). Роль десмосом в соединении клеток выявляется при некоторых формах потенциально смертельного

Рис. 14-10. Электронная микрофотография трех десмосом между двумя эпителиальными клетками в кишке крысы. [N. В. Gilula. In: Cell Communication (R.P. Cox, ed.), pp. 1-29. New York, Wiley, 1974. Reprinted by permission of John Wiley a. Sons, inc.]
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
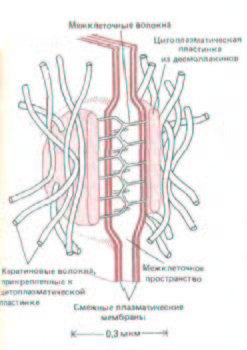
Рис. 14-11. Сильно схематизированное изображение десмосомы, С внутренней стороны каждой из смежных плазматических мембран находится электроноплотная пластинка, состоящая из смеси внутриклеточных прикрепительных белков, называемых десмоплакинами. Каждая пластинка связана с густой сетью кератиновых волокон, проходящих вдоль поверхности пластинки. Трансмембранные линкерные гликопротеины, называемые десмоглеинами, связываются с пластинками и своими внеклеточными доменами соединяют смежные мембраны при участии какого-то Са2 +-зависимого механизма. Хотя десмосомы и адгезионные пояса различаются морфологически и химически, они содержат по меньшей мере один общий внутриклеточный белок, называемый плакоглобином.
кожного заболевания пемфигуса, при котором у больных образуются антитела к одному или нескольким десмосомным линкерным гликопротеинам собственного организма; это приводит к разрушению десмосом между клетками эпидермиса и появлению многочисленных волдырей в результате просачивания тканевых жидкостей в разрыхленный эпителий. Антитела разрушают десмосомы только в коже, из чего следует, что десмосомы в других тканях, возможно, имеют иную биохимическую природу.
Полудесмосомы морфологически сходны с десмосомами, но отличаются от них функциональными и химическими особенностями. Они скрепляют не плазматические мембраны соседних клеток между собой, а базальную поверхность этих клеток с подстилающей базальной
мембраной - специализированной прослойкой внеклеточного матрикса на границе между эпителием и соединительной тканью (разд. 14.2.15).
Кроме того, если кератиновые филаменты, связанные с десмосомами, прикрепляются к последним своей боковой поверхностью (рис. 14-11), то многие филаменты, прикрепленные к полудесмосомам, оканчиваются в десмосомных пластинках (рис. 14-12).
И десмосомы, и полудесмосомы действуют как заклепки, распределяя сжимающие и растягивающие усилия по эпителию и подлежащей соединительной ткани.
14.1.5. Щелевые контакты позволяют малым молекулам переходить непосредственно из клетки в клетку [5]
Вероятно, это самый удивительный тип межклеточных соединений. Щелевые контакты относятся к наиболее распространенным - они весьма многочисленны в большинстве тканей и имеются практически у всех животных. На электронных микрофотографиях они выглядят как участки, где мембраны двух смежных клеток разделены узкой щелью шириной около 3 мкм. Щелевые контакты участвуют в межклеточной коммуникации, позволяя неорганическим ионам и другим малым водорастворимым молекулам прямо переходить из цитоплазмы одной клетки в цитоплазму другой и обеспечивая таким образом электрическое и метаболическое сопряжение между клетками. Такое сопряжение имеет важный функциональный смысл, многие аспекты которого мы еще только начинаем понимать.
Межклеточные связи такого типа были впервые продемонстрированы в 1958 г. физиологическими методами, однако потребовалось больше 10 лет, чтобы показать, что это физиологическое сопряжение коррелирует с наличием щелевых контактов, видимых в электронный микроскоп. Первые данные о таком сопряжении были получены при электрофизиологическом исследовании определенных пар взаимодействующих нейронов в нервной цепочке речного рака. При подаче разности потен-

Рис. 14-12. Расположение десмосом и полудесмосом в эпителиальных клетках тонкого кишечника. Сети кератиновых волокон соседних клеток связаны друг с другом через десмосомы, а с базальной мембраной - через полудесмосомы. Если к плотным пластинкам десмосом кератиновые волокна прикрепляются своей боковой поверхностью, то в полудесмосомах они закреплены своими концами.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
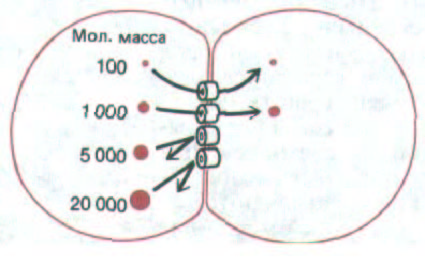
Рис. 14-13. Если в одну из двух клеток, соединенных щелевым контактом, ввести флуоресцирующие молекулы разной величины, то в другую клетку будут переходить лишь те из них, у которых мол. масса не превышает примерно 1000-1500 (в зависимости от типа клеток), а более крупные проходить не будут. Это соответствует эффективному диаметру межклеточного канала около 1,5 нм.

Рис. 14-14. Здесь схематически представлен радиоавтограф, демонстрирующий метаболическое сопряжение клеток, связанных щелевыми контактами, в культуре in vitro. Мутантные клетки лишены фермента тимидинкиназы и поэтому не могут включать в ДНК радиоактивный тимидин, добавленный в среду. Нормальные клетки способны включать тимидин в ДНК, и поэтому их ядра усеяны черными точками (зернами серебра в радиоавтографе). Как видно, в смешанной культуре нормальных и мутантных клеток радиоактивную метку включают также ядра тех мутантных клеток, которые соприкасаются с нормальными и устанавливают с ними щелевые контакты. Это обусловлено тем, что в нормальной клетке радиоактивный тимидин фосфорилируется тимидинкиназой с образованием тимидинтрифосфата; затем радиоактивный тимидинтрифосфат переходит через щелевые контакты в мутантную клетку и включается в ее ДНК.
циалов на два микроэлектрода, введенных в две взаимодействующие клетки, через мембрану в месте их соединения протекал ток неожиданно большой величины. Это указывало на то, что неорганические ионы (которые переносят электрические заряды в живых тканях) могут свободно переходить из одной клетки в другую. Последующие опыты показали, что небольшие флуоресцирующие молекулы, введенные в одну из клеток, тоже легко переходят в соседние клетки, не просачиваясь в межклеточное пространство, если только их молекулярная масса не превышала 1000-
1500. Из этого следовало, что эффективный диаметр соединительных каналов должен составлять около 1,5 нм (рис. 14-13) и что клетки обмениваются малыми молекулами (неорганическими ионами, сахарами, аминокислотами, нуклеотидами, витаминами и др.), но не макромолекулами (белками, нуклеиновыми кислотами и полисахаридами).
Такой обмен малыми внутриклеточными метаболитами составляет основу метаболической кооперации, которая может быть продемонстрирована на клетках в культуре. Например, можно выращивать клетки мутантных линий, у которых нет фермента тимидинкиназы, вместе с нормальными (дикого типа) клетками, у которых этот фермент есть. Мутантные клетки сами по себе не способны включать тимидин в ДНК, так как они не могут осуществлять первый этап этого процесса-превращение тимидина в тимидинтрифосфат. Если, однако, выращивать такие клетки совместно с клетками дикого типа в присутствии радиоактивного тимидина, то метка будет включаться в ДНК мутантных клеток, находящихся в прямом контакте с клетками дикого типа. Это означает, что какой-то предшественник ДНК, содержащий радиоактивный тимидин (очевидно, это тимидинтрифосфат), прямо переходит из клеток дикого типа в контактирующие с ними мутантные клетки (рис. 14-14). Такой метаболической кооперации не наблюдается, когда подобный эксперимент проводят с клетками, не способными к образованию щелевых контактов.
Есть и другие данные в пользу того, что за электрическое и химическое сопряжение между соприкасающимися клетками ответственны щелевые контакты. Типичные для таких контактов структуры можно обнаружить почти везде, где удается выявить сопряжение по электрическим или химическим критериям. И наоборот, сопряжение не выявляется между теми клетками позвоночных, у которых нет щелевых контактов. Кроме того, прохождение тока и красителя можно блокировать, если в клетки, соединенные щелевыми контактами, путем микроинъекции ввести антитела к главному белку такого контакта (см. ниже). Наконец, если этот белок щелевого контакта включить в искусственный липидный бислой или же мРНК, кодирующую этот белок, инъецировать в ооциты лягушки, то электрофизиологически можно будет обнаружить в этих объектах каналы со многими свойствами, присущими каналам щелевых контактов.
пронизывающего мембрану [6]
Щелевые соединения построены из трансмембранных белков, формирующих структуры называемые котексонами. Когда коннексоны плазматической мембраны двух соседних клеток совмещаются, они образуют непрерывный водный канал, соединяющий внутренность двух клеток (рис. 14-15). Коннексоны соединены так, что между смежными плазматическими мембранами остается щель (отсюда и название «щелевой контакт»), и в этом состоит отличие от плотного соединения, где
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 14-15. Модель щелевого контакта по данным биохимических исследований, электронной микроскопии и рентгеноструктурного анализа. Показаны соединенные таким контактом плазматические мембраны двух соседних клеток. Через оба липидных бислоя проходят белковые структуры, называемые конпексонами; как полагают, каждый коннексон состоит из шести идентичных белковых субъединиц. В результате соединения двух коннексонов образуется непрерывный водный канал, соединяющий одну клетку с другой.

Рис. 14-16. Большой и маленький щелевые контакты между фибробластами в культуре. Электронные микрофотографии тонкого среза (А)
и препарата, полученного методом замораживания -скалывания (Б). На сколе каждый щелевой контакт выглядит как скопление гомогенных межмембранных частиц, ассоциированных только с цитоплазматической стороной скола мембраны. Каждая межмембранная частица соответствует коннексону, показанному на рис. 14-15. [N.B. Gilula. In: Cell Communication (R.P. Cox, ed.), pp. 1-29. New York, Wiley, 1974. Reprinted by permission of John Wiley a. Sons, Inc.]

Рис. 14-17. Электронная микрофотография участка щелевого контакта, выделенного из печени крысы. Применен негативный контраст, чтобы показать коннексоны, организованные в гексагональную решетку. Электроноплотное центральное отверстие каждого коннексона имеет диаметр около 2 нм. [N. В. Gilula. In: Intercellular Junctions and Synapses (Receptors and Recognition, Series B, Vol. 2; J. Feldman, N.B. Gilula, and J.D.
Pitts, eds.), pp. 3-22, London. Chapman a. Hall, 1978.]
мембраны сближены теснее (ср. рис. 14-5 и 14-15). На электронных микрофотографиях препаратов, полученных методом замораживания-
скалывания, каждый коннексон виден как внутримембранная частица, и каждый щелевой контакт может содержать сотни сгруппированных вместе коннексонов (рис. 14-16).
Щелевые контакты благодаря их необычной устойчивости к протеолитическим ферментам и детергентам удается выделять из печени грызунов (рис. 14-17). Щелевой контакт состоит в основном из одного белка с мол. массой около 30000. Как показывает секвенирование ДНК, его полипептидная цепь (около 280 аминокислотных остатков) пересекает липидный бислой мембраны в виде четырех α-спиралей. Видимо, для образования каждого коннексона объединяются шесть таких белковых молекул, подобно тому как это, вероятно, происходит При построении канала рецептора ацетилхолина, где водную пору образуют шесть α -спиралей - по одной от каждой белковой субъединицы (см. рис. 6-64).
Антитела к белку с мол. массой 30000 реагируют со щелевыми контактами многих тканей и организмов; по-видимому, белки коннексона во всех случаях сходны (хотя биохимические и физиологические данные показывают, что они все же не идентичны). Это согласуется с тем фактом, что клетки различного типа в культуре обычно образуют щелевые контакты друг с другом, даже если они принадлежат разным видам.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 14-18. Действие антител к главному белку щелевого контакта, инъецированных в одну из клеток раннего зародыша Хепорus. Поперечные срезы нормального эмбриона (А) и зародыша после инъекции антител на 8-клеточной стадии (Б). Обратите внимание, что у второго из них на стороне инъекции отсутствует глаз и недоразвит мозг. (A. Warner, S. Guthrie, N. В. Gilula, Nature 331: 126-131, 1985. Copyright 1985 Macmillan Journals Limited.)
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1549; Нарушение авторских прав?; Мы поможем в написании вашей работы!