
- Р Р‡.МессенРТвЂР  В¶Р ВµРЎР‚
- ВКонтакте
- РћРТвЂР  Р…окласснРСвЂР  С”Р СвЂ
- РњРѕР№ Р СљР СвЂР ЎР‚
- LiveJournal
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы зарядов в веществах
|
|
|
|
Заряды в диэлектриках
Реальный диэлектрик состоит из сильно связанных зарядов, слабо связанных зарядо в и свободных зарядов
Сильно (упруго) связанные заряды - электроны в диэлектриках с ковалентной и ионной связями, ионы в кристаллических веществах с плотной упаковкой решетки ионами. Под действием электрического поля заряды упорядоченно смещаются из равновесных положений только на ограниченные расстояния: электроны смещаются в пределах атома или иона, ионы – в пределах элементарной кристаллической ячейки.
Слабо связанные заряды – диполи в полярных веществах; ионы в кристаллах с неплотно упакованной кристаллической решеткой, в аморфных веществах ионного строения, ионы, находящиеся в узлах решетки вблизи вакансий, ионы примесей и т.п. В отсутствие электрического поля слабо связанныезаряды могут находиться в нескольких равновесных положениях.
Из одного положения они хаотически перемещаются в другое под действием температуры.
Под действием электрического поля происходит направленное перемещение зарядов из одного равновесного положения в другое или поворот диполей. Смещение слабо связанныхзарядов происходит на большие расстояния, чем смещение сильно связанных зарядов.
Свободные заряды – свободные электроны и ионы, образующиеся в диэлектриках под действием высокой температуры, сильного электрического поля, ионизирующего изучения в результате ионизации или диссоциации диэлектрика или его примесей, а также диффузии электронов из металлических электродов. Под действием электрического поля свободные заряды приобретают в диэлектрике направленное движение, разряжаются на электродах и создают ток сквозной проводимости.
Заряды в проводниках и полупроводниках
В проводниках сильно связанными зарядами являются узлы кристаллической решетки (положительные ионы), свободными зарядами – свободные электроны (электронный газ).
В полупроводниках сильно связанными зарядами являются узлы кристаллической решетки и электроны, участвующие в ковалентных связях, свободными зарядами – свободные электроны и «дырки», возникающие при внешних энергетических воздействиях.
Ионная связь образуется за счет преимущественного смещения электронной плотности (вероятности нахождения электрона в данной точке пространства) валентных электронов взаимодействующих атомов в сторону более электроотрицательного атома.
Абсолютная электроотрицательность атома определяется как:
ЭО = W и + W с,
где W и – энергия ионизации, W с – сродство к электрону.
Энергия ионизации – количество энергии, которое нужно затратить, чтобы превратить нейтральный атом в положительно заряженный ион.
Сродство к электрону - количество энергии, которое выделяется при присоединении электрона к нейтральному атому, то есть при превращении его в отрицательный ион.
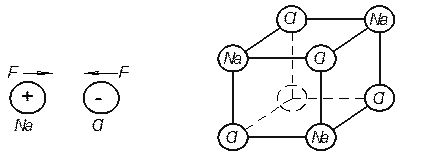
При формировании ионной связи образуются разноименно заряженные ионы, которые, притягиваясь друг к другу, создают устойчивую ионную кристаллическую решетку. Ионная связь реализуется, например, в кристаллах NaCl (рис. 1.10). На рис. 1.10a приведены изолинии электронной плотности. Большая толщина линий соответствует большей электронной плотности.
Ионная связь имеет большую величину Е (табл.1.1), поэтому вещества с такой связью имеют высокий модуль упругости, малую пластичность, высокие Т пл и Т исп, малый коэффициент температурного расширения. Вещества являются диэлектриками или полупроводниками, так как не имеют свободных зарядов (электронов и ионов), способных перемещаться в веществе под действием разности потенциалов и создавать электрический ток.
Таблица 1.1
Энергии кристаллической решетки некоторых кристаллов
| Кристалл | Энергия кристаллической решетки Е, кДж/моль или кДж/г-атом | Преимущественный тип связи |
| LiF | ионная | |
| NaCl | ||
| Алмаз | ковалентная | |
| SiC | ||
| Fe | металлическая | |
| Al | ||
| Поливинилхлорид | 134 (энергия термической деструкции) | межмолекулярная Ван-дер–Вальса |
| Н2О | межмолекулярная водородная |
Ковалентная связь образуется за счет обобществления электронов двух или более одинаковых или разнородных атомов.
Например, в алмазе каждый атом углерода достраивает свою валентную оболочку до полностью заполненного состояния за счет обобществления электронов четырех соседних атомов углерода (рис.1.11б).
|
|

|
|
|
|
|
|
|
|
|
Рис. 1.10. Ионная связь в кристалле NaCl: a) – распределение электронной плотности, б) – взаимодействие ионов, в) – кристаллическая решетка NaCl
В кристалле алмаза максимальная электронная плотность и, соответственно, максимальный отрицательный заряд создаются между катионами углерода (рис. 1.11в).
Указанные отрицательные заряды и катионы взаимодействуя друг к другом, создают устойчивую ковалентную кристаллическую решетку вещества.
Ковалентная связь реализуется и между различными атомами, например, в карбидах (Fe3C, SiC и др.) или нитридах (AlN и др.).
Ковалентная связь имеет большую величину Е (табл.1.1). Вещества имеют высокий модуль упругости, высокие значения Т пл и Т исп., малый коэффициент температурного расширения. Эти вещества полупроводники или диэлектрики.
Кроме того, ковалентная связь характеризуется направленностью, под которой подразумевают, что каждый атом вступает в обменное взаимодействие строго с определенным и ограниченным числом атомов. Поэтому ковалентные кристаллические решетки имеют малое координационное число и отличаются малой плотностью упаковки ионов, а вещества с ковалентной связью имеют низкую плотность.
|
|
|
|
|
|
|
|
|








|

Рис.1.11. Ковалентная связь в кристалле алмаза:
а) - электронное строение атома углерода, б) - схема ковалентной связи,
в) - распределение электронной плотности в кристалле алмаза
Металлическая связь заключается в обобществлении валентных электронов всех атомов металла с образованием так называемого электронного газа или электронов проводимости.
Металл состоит из положительных ионов, расположенных в пространстве в определенном порядке и совершающих непрерывные тепловые колебательные движения около положения равновесия и электронного газа (рис.1.12).
Взаимодействие электронного газа, имеющего отрицательный заряд, и положительных ионов приводит к образованию устойчивой кристаллической решетки металла. Электронная плотность примерно одинакова в любой точке межионного пространства.
Межмолекулярная связь обусловлена силами межмолекулярного притяжения (силами Ван-дер–Ваальса) между молекулами.

Рис. 1.12. Схема металлической связи в кристалле металла
Межмолекулярные силы имеют электрическую природу и являются результатом одновременного действия трех эффектов – ориентационного, индукционного и дисперсионного. Энергия межмолекулярного взаимодействия определяется как:
Е = Е о+ Е и+ Е д,
где Е о, Е и, Е д - энергииориентационного, индукционного и дисперсионного взаимодействий, соответственно.
Ориентационное притяжение (постоянный диполь - постоянный диполь) осуществляетсямежду молекулами, имеющими постоянный дипольный момент
m = |q|· r,
где |q| - модуль заряда диполя, r – расстояние между центрами положительного и отрицательного зарядов диполя. Энергия взаимодействия Е о ~ r -1.
Индукционное притяжение (постоянный диполь – наведенный индуцированный диполь) возникает между полярной и неполярной молекулами при условии, что последняя способна поляризоваться под действием постоянного диполя. Энергия взаимодействия Е и ~ r - 6.
Дисперсионное притяжение (мгновенный диполь – наведенный индуцированный диполь). В неполярных молекулах в результате случайных флуктуаций электронной плотности возникают мгновенные диполи, индуцирующие диполи в соседних неполярных молекулах. Энергия такого взаимодействия Е д ~ r - 6.
Особым типом межмолекулярного взаимодействия является водородная связь – связь между катионом водорода одной молекулы и анионом другой молекулы, например, N-3, О-2, F-1. Природа водородной связи двояка: c одной стороны – это диполь-дипольное взаимодействие, а с другой – донорно-акцепторное взаимодействие между электронами электроотрицательного атома и электроном атома водорода.
Наиболее важными классами материалов, где реализуется межмолекулярная связь, являются органические и неорганические полимерные материалы.
Межмолекулярная связь слабая, вещества с такой связью имеют малую энергию кристаллической решетки (табл. 1.5), низкие температуры плавления и кипения, малый модуль упругости. Молекулярные кристаллы – диэлектрики.
В материалах, как правило, реализуются одновременно несколько типов связей, а их количественная оценка имеет вероятностный характер. Например, в кристалле железа вероятность нахождения валентных электронов в виде электронного газа (вероятность металлической связи) составляет 55 %, а вероятность обобществления валентных электронов несколькими атомами (вероятность ковалентной связи) – 45 %.
Контрольные вопросы
1. Что такое материал?
2. Что изучает материаловедение?
3. Что такое кристаллическая решетка?
4. Какие типы элементарных кристаллических ячеек Вы знаете?
5. Что такое изотропия, анизотропия, квазиизотропия?
6. В чем заключается полиморфизм железа?
7. В чем причина перехода вещества из одной полиморфной модификации в другую?
8. Какие виды дефектов кристаллического строения Вы знаете?
9. Что такое энергия кристаллической решетки? Как она влияет на свойства материалов?
10. Какие типы связи между структурными частицами вещества Вы знаете?
РАЗДЕЛ 2: «ДЕФОРМАЦИЯ И МЕХАНИЧЕСКИЕ СВОЙСТВА МАТЕРИАЛОВ»
ЛЕКЦИЯ №2. «ДЕФОРМАЦИЯ И МЕХАНИЧЕСКИЕ СВОЙСТВА МАТЕРИАЛОВ»
|
|
|
Дата добавления: 2017-01-13; Просмотров: 1358; Нарушение авторских прав?; Мы поможем в написании вашей работы!