
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Город Красноярск, 14 декабря 2016 г
|
|
|
|
Классификация и свойства солей
Классификация и свойства кислот (гидроксидов неметаллов)
Классификация и свойства оснований (гидроксидов металлов)
Классификация и свойства оксидов
Оксидами называют соединения, состоящие из двух элементов, одним из которых является кислород.
| ОКСИДЫ | |||||

| 
| ||||
| Несолеобразующие | Солеобразующие | ||||

| 
| 
| 
| 
| 
|
| Безразличные СО, N2O, NO | Пероксиды Na2O2 | Солеобразные (двойные) Fe3O4 (FeO×Fe2O3) | Основные CuO CaO | Амфотерные ZnO Al2O3 Cr2O3 | Кислотные (ангидриды) CO2 SO3 |
Согласно современной международной номенклатуре любой оксид называется оксидом с указанием римскими цифрами степени окисления элемента, например:
CrO – оксид хрома (II)
Cr2O3– оксид хрома (III)
CrO3– оксид хрома (VI).
Получение оксидов
1. Взаимодействие с кислородом
2Mg + O2® 2MgOосновный оксид
4P + 5O2® 2P2O5кислотный оксид
2. Обжиг сульфидов
2CuS + 3O2® 2CuO + 2SO2
Свойства оксидов
Основные оксиды
1. Взаимодействие с водой оксидов щелочных и щелочноземельных металлов
(Li, Na, K, Rb, Cs, Ca, Sr, Ba)
Осн. ок. + вода = щелочь (растворимый гидроксид)
ВаО + Н2О ®Ва(ОН)2
2. Взаимодействие с кислотным оксидом
Осн.ок. + кисл.ок. = соль
СаО + СО2®CаСO3
3. Взаимодействие с кислотами
Осн.ок. + кислота = соль + вода
PbO + 2HNO3®Pb(NO3)2 + H2O
4. Разложение оксидов серебра и ртутипри нагревании
t0
2Ag2O® 4Ag + O2
Кислотные оксиды
1. Взаимодействие с водой
(кроме SiО2)
Кисл. ок. + вода = кислота
SО3 + Н2О ®H2SO4
2. Взаимодействие с основным оксидом
Осн.ок. + кисл.ок. = соль
N2O5 + FeO®Fe(NO3)2
3. Взаимодействие с щелочами
Кисл.ок. + щелочь = соль + вода
SO2 + 2NaOH®Na2SO3 + H2O
Амфотерные оксиды
1. Взаимодействие с кислотами
Амф.ок. + кислота = соль + вода
ZnO + 2HCl ® ZnCl2 + H2O
2. Взаимодействие с щелочами
Амф.ок. + щелочь = соль + вода
ZnO + 2NaOH®Na2ZnO2 + H2Oцинкат натрия
Na2[Zn(OH)4]тетрагидроксоцинкат натрия
Основания (гидроксиды металлов) - сложные вещества, при диссоциации которых отщепляются в качестве анионов только гидроксид-ионы.
| ГИДРОКСИДЫ | ||
| Однокислотные NaOH, NH4OH | Двухкислотные Mg(OH)2 | Трехкислотные Al(OH)3 |
| ГИДРОКСИДЫ | |
| Растворимые (щелочи) KOH, Ba(OH)2 | Нерастворимые Fe(OH)3, Cu(OH)2 |
Получение оснований
1. Получение щелочей
Металл I-IIгр + вода = щелочь + водород
Оксиды металлов I-IIгр + вода = щелочь
2Na + 2H2O ® 2NaOH + H2
СаО + H2O ®Сa(OH)2
2. Получение нерастворимых оснований
Соль + щелочь = основание + вода
CuSO4 + KOH ®Сu(OH)2¯+ K2SO4
Свойства оснований
1. Реакция нейтрализации
Основание + кислота = соль + вода
Ni(OH)2 + HCl® NiCl2 + H2O
2. Разложение нерастворимых оснований
t
2Fe(OH)3® Fe2O3 + 3H2O
3. Свойства амфотерных оснований
Амф.основание + щелочь = соль + вода
Al(OH)3 + KOH®K3AlO3 + H2Oалюминат калия
K[Al(OH)4] тетрагидроксоалюминат калия
Кислоты – это сложные вещества, при диссоциации которых в качестве катионов отщепляются катионы водорода.
| КИСЛОТЫ | |
| Бескислородные HF, H2S | Кислородсодержащие H2SO4 |
| КИСЛОТЫ | ||
| Одноосновные HCl, HNO3 | Двухосновные H2SO4 | Трехосновные H3PO4 |
Получение кислот
1. Бескислородных кислот
Неметалл + водород = кислота
Н2 + Cl2® 2HCl
2. Кислородсодержащих кислот
Кисл.оксид + вода = кислота
SO2 + H2O ® H2SO3
Свойства кислот
1. Реакция нейтрализации
Основание + кислота = соль + вода
Mg(OH)2 + HNO3® Mg(NO3)2 + H2O
2. Взаимодействие с основными оксидами
Осн.ок. + кислота = соль + вода
MnO + 2HCl®MnCl2 + H2O
3. Взаимодействие с металлами
Металл + разб. кислота = соль + водород
Zn + HCl®ZnCl2 + H2
Cu + HCl¹
Соли – сложные вещества, которые в водных растворах диссоциируютна
| Средние соли | Кислые соли | Основные соли |
| положительно заряженные ионы металлов (или катионы NH4+) и отрицательно заряженные ионы (анионы) кислотных остатков KCl, Fe(NO3)3 | положительно заряженные ионы металлов (или катионы NH4+), катионы водорода и отрицательно заряженные ионы (анионы) кислотных остатков NaHCO3, Mg(HSO4)2 | положительно заряженные ионы металлов (или катионы NH4+),отрицательно заряженные ионы (анионы) кислотных остатков и гидроксид-ионы (CuOH)2CO3, MgOHCl |
Получение солей
Реакция нейтрализации
KOH + HCl®KCl + H2O средняя соль
Если в реакцию нейтрализации вступает основание и многоосновная кислота, то возможно образование кислых солей:
NaOH + H2SO3®NaHSO3 + H2O кислая соль – гидросульфит натрия
При дальнейшем добавлении щелочи образуется средняя соль:
NaOH +NaHSO3®Na2SO3 + H2O средняя соль – сульфит натрия.
Таким образом, при недостатке щелочи образуется кислая соль (соотношение щелочь: кислота = 1: 1), а при избытке щелочи (соотношение щелочь: кислота = 2: 1) – средняя.
2 NaOH +H2SO3®Na2SO3 + 2H2O.
Если же в реакцию нейтрализации вступает кислота и многокислотное основание, то возможно образование основных солей:
Mg(OH)2 + HCl®MgOHCl + H2O
При дальнейшем добавлении кислоты образуется средняя соль:
MgOHCl + HCl®MgCl2 + H2O
При недостатке кислоты образуется основная соль, при избытке кислоты – средняя:
Mg(OH)2 + 2 HCl ® MgCl2 + H2O
Свойства солей
1.Взаимодействие с металлами (эти реакции всегда окислительно-восстановительные):
Fe + CuSO 4 = Cu + FeSO 4
Cu + FeCl 3 = CuCl + FeCl 2
2.Взаимодействие с неметаллами (окислительно-восстановительные реакции):
S + Na2SO3 = Na2S2O3 - при кипячении
3.Взаимодействие с водой - образуются кристаллогидраты:
CuSO4 + 5Н2О = CuSO4  5H2O
5H2O
Na2SO4 + 10Н2О = Na2SO4  10H2O
10H2O
или необратимо гидролизуются:
Al2S3 + 6Н2O = 2Al(OH)3 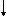 + 3H2S
+ 3H2S 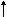
4.Взаимодействие со щелочами:
NH4Cl + NaOH = NH3 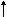 + NaCl + H2O
+ NaCl + H2O
CuCl 2 + NaOH = NaCl + Cu(OH)2 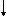
5.Взаимодействие с кислотами:
K2CO3 + HCl = KCl + CO2 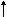 + H2O
+ H2O
NaNO3(тв) + H2SO4(конц) = NaHSO4 + HNO3 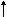 - при нагревании
- при нагревании
Ca3(PO4)2 + H3PO4 = 3CaHPO4
6.Взаимодействие с солями:
NaCl + AgNO3 = NaNO3 + AgCl 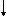
7. При нагревании кислородсодержащие соли разлагаются:
2KClO3 = 2KCl + 3O2 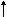
CaCO3 = CaO + CO2 
(Определения, формулы, графики и уравнения реакций даются под запись.)
ЗАКЛЮЧИТЕЛЬНАЯ ЧАСТЬ (2 мин.)
Преподаватель отвечает на вопросы обучаемых, приводит список литературы, рекомендуемый для самостоятельного углубленного изучения темы.
|
|
|
|
|
Дата добавления: 2017-01-13; Просмотров: 653; Нарушение авторских прав?; Мы поможем в написании вашей работы!