
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронные потенциалы и электродвижущие силы
|
|
|
|
При решении задач этого раздела см. табл. 8,
Если металлическую пластинку опустить в воду, то катионы металла на ее поверхности гидратируются полярными молекулами воды и переходят в жидкость. При этом электроны, в избытке остающиеся в металле, заряжают его поверхностный слой отрицательно. Возникает электростатическое притяжение между перешедшими в жидкость гидратированными катионами и поверхностью металла. В результате этого в системе устанавливается подвижное равновесие:
Me + m H2O 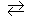
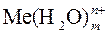 + ne –
+ ne –
в растворе на металле
где п – число электронов, принимающих участие в процессе. На границе металл – жидкость возникает двойной электрический слой, характеризующийся определенным скачком потенциала – электродным потенциалом. Абсолютные значения электродных потенциалов измерить не удается. Электродные потенциалы зависят от ряда факторов (природы металла, концентрации, температуры и др.). Поэтому обычно определяют относительные электродные потенциалы в определенных условиях – так называемые стандартные электродные потенциалы (Е °).
Стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор собственного иона с концентрацией (или активностью), равной 1 моль/л, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 25°С условно принимается равным нулю (Е ° = 0; D G ° = 0).
Располагая металлы в ряд по мере возрастания их t стандартных электродных потенциалов (E ° ), получаем так называемый ряд напряжений.
Положение того или иного металла в ряду напряжений характеризует его восстановительную способность, а также окислительные свойства его ионов в водных растворах при стандартных условиях. Чем меньше значение E °, тем большими восстановительными способностями обладает данный металл в виде простого вещества, и тем меньшие окислительные способности проявляют его ионы, и наоборот. Электродные потенциалы измеряют в приборах, которые получили название гальванических элементов. Окислительно-восстановительная реакция, которая характеризует работу гальванического элемента, протекает в направлении, в котором ЭДС элемента имеет положительное значение. В этом случае D G ° < 0, так как D G ° = = – nFE °.
Пример 1. Стандартный электродный потенциал никеля больше, чем кобальта (табл. 8). Изменится ли это соотношение, если измерить потенциал никеля в растворе его ионов с концентрацией 0,001 моль/л, а потенциалы кобальта – в растворе с концентрацией 0,1 моль/л?
Таблица 8.
Стандартные электродные потенциалы (E °)
некоторых металлов (ряд напряжений)
| Электрод | E °, В | Электрод | E °, В |
| Li+/Li | -3,045 | Cd2+/Cd | -0,403 |
| Rb+/Rb | -2,925 | Co2+/Co | -0,277 |
| K+/K | -2,924 | Ni2+/Ni | -0,25 |
| Cs+/Cs | -2,923 | Sn2+/Sn | -0,136 |
| Ba2+/Ba | -2,90 | Pb2+/Pb | -0,127 |
| Ca2+/Ca | -2,87 | Fe3+/Fe | -0,037 |
| Na+/Na | -2,714 | 2H+/H2 | -0,000 |
| Mg2+/Mg | -2,37 | Sb3+/Sb | +0,20 |
| Al3+/Al | -1,70 | Bi3+/Bi | +0,215 |
| Ti2+/Ti | -1,603 | Cu2+/Cu | +0,34 |
| Zr4+/Zr | -1,58 | Cu+/Cu | +0,52 |
| Mn2+/Mn | -1,18 | Hg2+2/2Hg | +0,79 |
| V2+/V | -1,18 | Ag+/Ag | +0,80 |
| Cr2+/Cr | -0,913 | Hg2+/Hg | +0,85 |
| Zn2+/Zn | -0,763 | Pt2+/Pt | +1,19 |
| Cr3+/Cr | -0,74 | Au3+/Au | +1,50 |
| Fe2+/Fe | -0,44 | Au+/Au | +1,70 |
Решение. Электродный потенциал метала (E) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
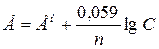 ,
,
где E ° – стандартный электродный потенциал; n – число электронов, принимающих участие в процессе; С – концентрация (при точных вычислениях – активность) гидратированных ионов металла в растворе, моль/л; E ° для никеля и кобальта соответственно равны -0,25 и -0,277 В. Определим электродные потенциалы этих металлов при данных в условии концентрациях:
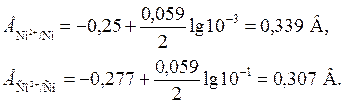
Таким образом, при изменившейся концентрации потенциал кобальта стал больше потенциала никеля.
Пример 2. Магниевую пластинку опустили в раствор его соли. При этом электродный потенциал магния оказался равен -2,41 В. Вычислите концентрацию ионов магния (в моль/л).
Решение. Подобные задачи также решаются на основании уравнения Нернста (см. пример 1):
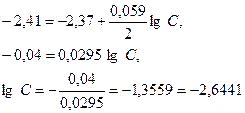
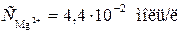 .
.
Пример 3. Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 1 моль/л. Какой металл является анодом, какой катодом? Напишите уравнение окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, и вычислите его ЭДС.
Решение. Схема данного гальванического элемента
(–) Mg |Mg2+| |Zn2+| Zn (+)
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки – границу раздела двух жидких фаз – пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (–2,37 в) и является анодом, на котором протекает окислительный процесс:
Mg0 – 2 e – = Mg2+ (1)
Цинк, потенциал которого -0,763 В, – катод, т.е. электрод, на котором протекает восстановительный процесс:
Zn2++2 е – = Zn0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg + Zn2+ = Mg2+ + Zn
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе равна 1 моль/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
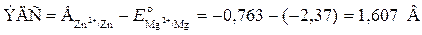 .
.
Контрольные вопросы
241.В два сосуда с голубым раствором медного купороса поместили в первый цинковую пластинку, а во второй серебряную. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте электронные и молекулярное уравнения соответствующей реакции.
242.Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: a) CuSО4; б) MgSO4; в) Рb(NО3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
243.При какой концентрации ионов Zn2+ (в моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала? Ответ: 0,30 моль/л.
244.Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: а) АgNO3; б) ZnSO4; в) NiSO4? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
245. Марганцевый электрод в растворе его соли имеет потенциал –1,23 В. Вычислите концентрацию ионов Mn2+ (в моль/л). Ответ: 1,89 • 10–2 моль/л.
246.Потенциал серебряного электрода в растворе АgNО3 составил 95% от значения его стандартного электродного потенциала. Чему равна концентрация ионов Аg+ (в моль/л)? Ответ: 0,20 моль/л.
247.Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС медно-кадмиевого гальванического элемента, в котором [Cd2+] = 0,8 моль/л, a [Сu2+] = 0,01 моль/л. Ответ: 0,68 В.
248.Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
249.При какой концентрации ионов Сu2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода? Ответ: 1,89 • 10 –12 моль/л.
250.Какой гальванический элемент называется концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных: первый в 0,01 н., а второй в 0,1 н. растворы AgNO3. Ответ: 0,059 В.
251.При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод – в 0,01 М растворе сульфата никеля. Ответ: 0,0295 В.
252.Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Pb2+] = [Mg2+] = 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого, из ионов увеличить в одинаковое число раз? Ответ: 2,244 В.
253.Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
254.Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде.
255.Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Mg2+] = [Cd2+] = 1 моль/л. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/л? Ответ: 1,967 В.
256.Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ионы железа (моль/л), чтобы ЭДС элемента стала равной нулю, если [Zn2+] = 0,001 моль/л? Ответ: 7,3 • 10–15 моль/л.
257.Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb(NO3)2 = Ni(NO3)2 + Pb
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Ni2+] =0,01 моль/л, [Pb2+] = 0,0001 моль/л. Ответ: 0,064 В.
258.Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
259.Какие химические процессы протекают на электродах при зарядке и разрядке кадмий-никелевого аккумулятора?
260. Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора?
|
|
|
|
|
Дата добавления: 2017-01-13; Просмотров: 481; Нарушение авторских прав?; Мы поможем в написании вашей работы!