
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретическая часть. Определение энтальпии нейтрализации
|
|
|
|
Определение энтальпии нейтрализации.
Лабораторная работа №4
Цель работы: определить энтальпию (теплоту) нейтрализации. Проверить
выполнение закона Гесса.
Реакция нейтрализации:
Реакция между щелочью NaOH и кислотой (Η2SO4) называется
реакцией нейтрализации.
1)H2SO + 2NaOH = Na2 SO4 + 2H2 O(ж); ΔΗ0
2H+ + 2OH- = 2H2O
Реакцию 1 можно осуществить в 2 стадии:
А) H 2SO4 + NaOH= Na2 SO4 + H2O(ж) ΔН01
H++ OH- = H2 O
Б) NaHSO4 + NaOH Na2 SO4 + H2O(ж) ΔН02
H++ OH = H2 O
Согласно закону Гесса:
ΔΗ0 = ΔН01+ ΔН02
Расчет теплоты нейтрализации.
Реакции 1, а, б, можно провести в калориметре и, измерив температуру
раствора кислоты до реакции (t1) и после реакции, т.е. после приливания
раствора NaOH (t2), можно рассчитать теплоту реакции (ΔΗ, кДж/моль) по
уравнению:
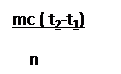 |
ΔΗ = Qρ =
где m – масса раствора после нейтрализации. Учитывая, что m=Vp,
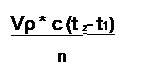 |
ΔΗ =
где V – объем раствора после нейтрализации, мл; p – плотность раствора
после нейтрализации, г/мл; c – удельная теплоемкость раствора после нейтрализации, кДж/г. град; t2 – температура раствора после нейтрализации, 0С; t1 – температура раствора до нейтрализации, 0С; n количество кислоты, принимавшее участие в реакции нейтрализации, моль, в условиях опыта, выполняемого в данной работе n=0,1 моль.
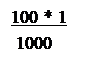
n= = 0, 1
Теоретическое значение теплоты нейтрализации можно рассчитать
используя следствие из закона Гесса:
ΔH0298 = ΣΔH0 F 298 продуктов реакции -- ΣΔH0 F 298 продуктов веществ и справочные данные по теплотам образования участков реакции,
приведенные в табл. 4.1.
Таблица 4.1
Теплота образования некоторых веществ
| Вещество | Теплота образования в-ва ΔΗ0F, кДж/моль |
| Na2SO4 раствор | -1403,36 |
| H2SO4 раствор | -904,50 |
| NaOH раствор | -470,12 |
| K2SO4 раствор | -1405,38 |
| KOH раствор | -482,69 |
| NaCl раствор | -406,54 |
| H2O жид. | -285,84 |
Результат выполнения заданий для самостоятельной подготовки к лабораторной работе №4:
| № варианта | № задания, величина, её обозначение, еденица измерения | |||
|
|
|
|
Дата добавления: 2017-01-13; Просмотров: 337; Нарушение авторских прав?; Мы поможем в написании вашей работы!