
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Единицы измерения. Бор образует по два карбида с точно известной структурой – В4С и В13С2
|
|
|
|
Бор образует по два карбида с точно известной структурой – В4С и В13С2. Наибольшее значение имеет первый из них – черные блестящие кристаллы, которые по твердости уступают лишь алмазу и нитриду бора BN. Этот карбид применяют для изготовления абразивных и шлифовальных материалов и в качестве полупроводника. Карбид, обогащенный изотопом 10В, используется как поглотитель нейтронов в ядерных реакторах.
Карбид вольфрама WC используют также для изготовления буровых коронок, деталей аппаратуры для производства синтетических алмазов, для нанесения износостойких покрытий на поверхности металлов. Это вещество, как и карбид вольфрама, используют как компонент жаропрочных, жаростойких и твердых сплавов, для получения износостойких покрытий, для изготовления тугоплавких тиглей, в которых можно плавить почти любые металлы (сам карбид плавится при 3257° С). Карбидом титана выкладывают внутренние стенки высокотемпературных печей.
Карбиды, как оказалось, можно получить не только в лаборатории. Еще до работ Муассана австрийский ученый Э.Вайнсхенк в 1889 открыл в метеоритах минерал когенит, представляющий собой смешанный карбид железа, кобальта и никеля состава (FeNiCo)3C. А сам Муассан в 1904 обнаружил в метеорите, привезенном из каньона Диабло в штате Аризона, темно-зеленый минерал, представляющий собой карбид кремния SiC. Этот минерал в честь ученого назвали муассанитом.
Впервые необычное соединение металла с углеродом (К2С2) получил в 1809 знаменитый английский химик Гемфри Дэви. В 1863 французский химик Марселен Бертло изучил свойства другого карбида – очень неустойчивого и легко взрывающегося карбида одновалентной меди Cu2C2. В 1878 немецкий металлург Ф.Мюллер, растворив образцы стали в разбавленной серной кислоте, выделил карбид железа Fe3C. Но только в конце 19 в. французский химик Анри Муассан, прославившийся получением фтора, синтезировал многие из этих необычных соединений и изучил их свойства. Он получал карбиды, нагревая до очень высокой температуры смеси древесного угля с разными металлами, их оксидами или карбонатами. Для этого он использовал жар вольтовой дуги в электрической печи собственной конструкции.
Раньше карбиды классифицировали по их устойчивости к действию воды и кислот, а также по тому, какие газы выделяются при их разложении. Современная классификация учитывает тип химической связи между атомами в карбидах – именно от этого зависят в основном физические и химические свойства. В соответствии с этой классификацией, карбиды можно разделить на три группы, которые довольно сильно отличаются по своим свойствам.
К первой группе относятся так называемые солеобразные карбиды с ионной связью. Эти карбиды образуют щелочные и щелочноземельные металлы, алюминий, редкоземельные элементы, а также актиноиды. Их состав иногда соответствует типичным валентностям металлов (Al4C3), а иногда – нет (Ве2С). Многие ионные карбиды можно получить непосредственно из элементов (Са + 2С → СаС2) или восстановлением оксидов углеродом (СаО + 3С → СаС2 + СО). Ионный характер связи приводит к высокой температуре плавления; например, карбид кальция СаС2 плавится при 2300°С, карбид тория ThC2 – при 2655° С. Водой или разбавленными кислотами ионные карбиды легко разлагаются – гидролизуются. При этом образуются различные углеводороды и гидроксид металла. Самый известный пример – получение ацетилена гидролизом карбида кальция: СаС2 + 2Н2О → Ca(OH)2 + С2Н2. Ацетилен выделяется также при гидролизе Na2C2, К2С2 и др. Поэтому такие карбиды можно рассматривать как производные ацетилена, в которых атомы водорода замещены атомами металла. При этом катионы металла и анионы С2–2 размещаются в соответствующих узлах кристаллической решетки. Солеобразный характер этих карбидов подтверждается возможностью их электролиза в расплавленном состоянии. Интересно отметить, что чистый карбид кальция – бесцветные кристаллы, хотя увидеть их непросто, так как обычный технический продукт имеет цвет от бурого до черного.
Взаимодействие карбидов щелочных металлов с водой протекает исключительно бурно. Так, если карбид калия просто облить водой, произойдет бурная реакция, которая сопровождается взрывом такой силы, что выделяющийся ацетилен сразу же разлагается с выделением угля. Чтобы провести реакцию К2С2 + 2Н2О → 2КОН + С2Н2, надо медленно пропускать над карбидом водяной пар.
В ряде случаев карбиды ионного типа образуются непосредственно при пропускании ацетилена через растворы солей металлов. Так карбиды серебра, меди(I), золота и ртути, которые чаще называют ацетиленидами. Ацетилениды щелочных металлов можно получить действием ацетилена на свободные металлы. В сухом виде ацетилениды тяжелых металлов легко разлагаются со взрывом. Гидролиз ионных карбидов других металлов показывает, что они «происходят» из других углеводородов. Например, при гидролизе карбида алюминия выделяется метан: Al4C3 + 12H2O → 4Al(OH)3 + 3CH4 (так же гидролизуется карбид бериллия Ве2С), а при гидролизе карбида магния получается метилацетилен: Mg2C3 + 4H2O → 2Mg(OH)2+ НС≡С–СН3. Интересно, что карбид магния другого состава, MgC2, дает при гидролизе только ацетилен. Иногда при гидролизе ионных карбидов углеводороды выделяются совместно с водородом, который частично гидрирует непредельные углеводороды. С выделением почти равных количеств водорода и метана разлагается карбид марганца: Mn3C + 6H2O → 3Mn(OH)2 + CH4 + H2. Карбиды редкоземельных металлов и тория при разложении разбавленными кислотами выделяют не чистый ацетилен, а его смесь с метаном, этиленом и другими углеводородами. Например, при гидролизе карбида церия СеС2 получается смесь ацетилена с метаном в соотношении 4:1, а также немного этилена и жидких и твердых углеводородов (состав продуктов зависит от условий проведения реакции). Еще больше жидких и твердых углеводородов дает при гидролизе карбид урана.
Ко второй группе относятся карбиды, которые образуют переходные металлы IV–VII групп, а также кобальт, железо и никель. Это металлоподобные соединения с другой структурой. В них атомы углерода, имеющие небольшие размеры, не связаны друг с другом и располагаются в пустотах между атомами металлов. Различная упаковка атомов металла в кристаллической решетке приводит к разному составу карбидов даже для одного и того же металла; например, хром образует карбиды состава Cr3C2, Cr4C, Cr7C3 и др. Эти карбиды (их называют карбидами внедрения) часто отличаются большой твердостью и очень высокими температурами плавления. Например, карбиды тантала и гафния TaC и HfC – наиболее тугоплавкие из известных веществ (плавятся при 3985 и 3890° С соответственно).
Металлоподобные карбиды обладают высокой электропроводностью и очень высокой химической стойкостью к агрессивным средам (многие из них не растворяются даже в царской водке). Они используются для упрочнения чугуна и стали (карбиды железа, хрома, вольфрама, молибдена), а также для производства очень твердых сплавов, которые применяют для обработки металлов резанием (карбиды WC, TiC, TaC, VC, Cr3C2). Например, твердые наконечники резцов, сверл делают из победита – спеченного порошка карбида вольфрама WC с добавкой металлического кобальта. Очень важную роль играет карбид железа Fe3C (цементит) – твердые кристаллы, входящие в структуру чугуна и стали.
К третьей группе относятся ковалентные карбиды. Их образуют кремний и бор – соседи углерода по периодической таблице, близкие к нему как по размеру атомов, так и по электроотрицательности. Карбид кремния SiC (техническое название – карборунд) в чистом виде – бесцветные кристаллы, но примеси часто окрашивают его в различные цвета, вплоть до черного. По своей структуре это соединение аналогично алмазу; решетку карбида кремния можно получить, если в немного расширенной решетке алмаза заменить половину атомов углерода на атомы кремния. Это вещество обладает очень высокой твердостью; помимо этого оно имеет свойства полупроводника. Из него делают шлифовальные бруски и круги, огнеупорные материалы для печей и литейных машин, нагревательные элементы для электропечей, полупроводниковые диоды.
В 1982 г. русский учёный Соколов В.Д. предложил так называемую “ космическую ” гипотезу, согласно которой углеводороды нефти образованы из углерода и водорода в эпоху формирования Земли и других планет.
Предполагалось, что образовавшиеся углеводороды находились в газовой оболочке, а по мере остывания поглощались породами формировавшейся земной коры. Высвобождаясь затем из остывавших магматических пород, углеводороды поднимались в верхнюю часть земной коры, где образовывали скопления. В основу этой гипотезы были положены факты о наличии углерода и водорода в хвостах комет и углеводородов в метеоритах. Согласно современным данным, в атмосфере Юпитера и Титана, а также в газопылевых облаках обнаружены C2H2, C2H4, C2H6, С3Н8, HCN, C2N2. В метеоритах (углистых хондритах) найдены твердые углистые вещества, нормальные алканы, аминокислоты, однако происхождение их неясно. Когда речь идет о низких концентрациях, не исключено загрязнение метеоритов при падении на Землю. Кроме того, рядом ученых в метеоритах обнаружены форменные органические образования, очень сходные с простейшими одноклеточными организмами древнейших пород Земли. Во всяком случае к объяснению поступления минеральной нефти из больших глубин Земли эти факты о нахождении органических веществ в метеоритах прямого отношения не имеют.
Глубинные массивные кристаллические периодитовые породы, как и метиориты, содержат элементарный углерод и карбиды тяжёлых металлов. Эти же породы содержат воду, водород, окись углерода и углекислоту. В этой связи выдвинут целый ряд других гипотез о неорганическом происхождении нефти и газа в недрах Земли в результате химических реакций непосредственно из углерода и водорода в условиях высоких температур, давлений и каталитического действия оксидов металлов (Fe, Ni и др.) (Н.А. Кудрявцев, В.Б. Порфильев и др.).
Химизм получения углеводородов из окиси углерода и водорода известен благодаря исследованиям учёных: Е.И. Орлова, Н.Д. Зелинского и других.
Процесс первого синтеза углеводородов из СО и Н2 был осуществлён русским химиком Е.И. Орловым в г. Харькове (1908 г.), получившим из смеси СО и Н2 простейший олефиновый углеводород - этилен, очевидно по схеме:
2СО + 4Н2 → С2Н4 + 2Н2О
Эта реакция была проведена при температуре 100°С и при контакте с катализатором, состоящим из Ni + Pd, осаждённых на коксе.
Позднее было установлено, что в результате получается не только этилен, но и ряд других, более сложных алкенов.
Тяжёлые металлы подгруппы железа, особенно в присутствии окиси алюминия и магния, как под давлением, так и без давления способствует образованию углеводородов сложного состава и разных рядов:
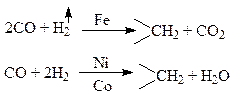
В зависимости от условий реакции в качестве конечных продуктов могут быть не только жидкие углеводороды и вода, но также и твёрдые парафины и церезины, газы – метан и его ближайшие гомологи и углекислота.
В первой половине XX века интерес к гипотезе минерального происхождения нефти в основном был потерян. Поиски нефти велись во всем мире, исходя из представлений об ее органическом происхождении.
С середины прошлого века интерес к минеральной гипотезе снова начал возрастать, причиной чего была, по-видимому, недостаточная ясность ряда вопросов органической концепции, что и вызывало ее критику.
Некоторую известность получила магматическая гипотеза образования нефти. На больших глубинах – в мантии Земли – в условиях очень высокой температуры углерод и водород образуют углеводородные радикалы СН, СН2 и СН3. Вследствие перепада давления они перемещаются по веществу мантии в зоны глубинных разломов и вдоль этих разломов поднимаются вверх, ближе к земной поверхности. По мере понижения температуры в верхних слоях эти радикалы соединяются друг с другом и с водородом. В результате возникают различные более сложные нефтяные углеводороды. К ним присоединяются другие углеводороды, образующиеся из окиси углерода и водорода, а также из карбидов различных металлов и воды по реакциям, указанным М. Бертло, Д.И. Менделеевым и др. Разнообразие реакций обеспечивает и чрезвычайное разнообразие возникающих углеводородов, смесь которых в основном и составляет природную нефть.
Дальнейшее движение углеводородных газов и нефти приводит их или на поверхность Земли, или в ловушки, создающиеся в проницаемых породах осадочного покрова, а иногда и в кристаллических породах на границе с ними. Передвижение (миграция) углеводородов происходит по заполненным водой трещинам и вызвано огромным перепадом давлений в местах образования нефти и осадочной толщи, а также разностью плотностей воды и нефти.
В поисках доказательств абиогенного синтеза нефти некоторые исследователи обращались к промышленным процессам получения синтетического топлива. Однако по мере углубления знаний о составе нефти отчетливо выявились глубокие различия в составе природных и синтетических углеводородных смесей. Последние практически не содержат широко представленных в нефти сложнопостроенных углеводородных молекул, насыщенных структурных аналогов компонентов живого вещества – жирных кислот, терпенов, стеролов и т. д.
Ряд аргументов сторонников минерального происхождения нефти основан на термодинамических расчетах. Была сделана попытка определить температуру нефтеобразования по соотношениям между некоторыми изомерными углеводородами, допуская, что высокотемпературный синтез приводит к появлению термодинамически равновесных смесей. Рассчитанная таким образом температура нефтеобразования составила 450-900°С, что соответствует температуре глубинной зоны 100-160 км в пределах верхней мантии Земли. Однако для тех же нефтей расчет по другим изомерным парам дает другие значения температуры (от –100 до 20000°С), совершенно нереальные в условиях земной коры и мантии.
Геологические доказательства минеральной гипотезы – наличие следов метана и некоторых нефтяных углеводородов в глубинных кристаллических породах, в газах и магмах, извергающихся из вулканов, проявления нефти и газа по некоторым глубинным разломам и т.п. – являются косвенными и всегда допускают двойную трактовку. Внедряющиеся в земную кору глубинные породы расплавляют и ассимилируют осадочные породы с имеющимся в них биогенным органическим веществом; жерла вулканов также проходят через осадочные толщи, причем иногда регионально-нефтегазоносные, поэтому находимые в них СН4и некоторые другие нефтяные углеводороды могли образоваться не только в результате минерального синтеза, но и при термической деструкции захваченного биогенного органического вещества осадочных пород или при поступлении нефти в осадочные породы уже после остывания магматических пород. Главное доказательство органической концепции состоит в большом сходстве химических и геохимических показателей соединений нефти с аналогичными компонентами органического вещества современных осадков и древних осадочных пород.
Концепция неорганического происхождения нефти и природных газов, так же как и органическая концепция, базируется на ряде геологических наблюдений и химических опытах.
Сторонники неорганической концепции отмечают, в частности, что в мире известно около 30 промышленных или полупромышленных залежей нефти, приуроченных к изверженным и метаморфическим породам. Кроме того, имеются упоминания о более чем 200 случаях минералогических включений углеводородов в изверженных или метаморфических породах. Например, асфальтит отмечается в пегматитовых жилах ряда месторождений марганца в Швеции и Норвегии. В Канаде найдена жидкая нефть, связанная с пегматитовой жилой, пронизывающей изверженные породы.
Признаки жидкой нефти отмечены в продуктах извержения вулканов Этна (Сицилия) и Кракатау (Малайский архипелаг). Еще более эффективные нефтепроявления в связи с магматической деятельностью наблюдались при изучении вулкана Толима в Центральных Андах и ныне угасшего вулкана Эгмонт в Новой Зеландии. Сторонники неорганической концепции подсчитали, что все вулканы мира в среднем ежегодно выбрасывают около 3,3·105 т углеводородов.
Каждая из двух концепций имеет уязвимые места. Но господствующей в настоящее время является органическая концепция. Эта концепция отличается большей стройностью, зрелостью и завершенностью суждений. В своем становлении она прошла этапы весьма сложной внутренней борьбы представителей различных научных школ и направлений. Поэтому в современном виде органическая концепция практически однозначно трактуется всеми ее сторонниками.
В вопросе о происхождении нефти есть приверженцы и комплексного подхода. Они считают, что могли существовать оба механизма образования нефти (органический и неорганический), определенной мерой дополняя друг друга или действуя на разных стадиях процесса.
Однако следует сказать, что неорганические гипотезы происхождения нефти находятся в противоречии и с геологическими данными и современными знаниями о составе нефтей.
В нефтяной промышленности для ряда физических величин сложилась своя система мер, отличная от системы «СИ». Кроме того, в ряде стран используются свои единицы измерения. Прежде всего, это касается объема. При международных торговых операциях нефть продается не по массе, а по объему и единицей измерения служит нефтяной баррель (barrel, бочка, в переводе с английского).
Единицы измерения объема:
1 нефтяной баррель (barrel of oil) = 158,988 л;
1 галлон США (U.S. gallon) = 3,785 л;
1 кубический фут (cublc foot, c.f.) = 0,0283 м3 = 28,3 л.
Единицы измерения плотности. Плотность измеряют в кг/м3, г/см3.
Относительная плотность, обозначаемая как ρ4 20 или d420 - это отношение плотности нефтепродукта при 20 °С к плотности воды при 4°С. Поскольку последняя равна 1 г/см3, относительная плотность нефтепродукта численно равна плотности, выраженной в г/см3.
Единица измерения плотности нефтепродуктов в США - °API (градусы эй-пи-ай).
Единицы измерения концентрации. Для обозначения концентрации отдельных компонентов в нефтепродукте используют всем привычные проценты. Также качество нефтепродуктов во многом определяется содержанием в нем микропримесей (сера, азот, металлы), концентрация которых невелика. Но и в этой концентрации примеси достаточно сильно влияют на работу технологических процессов, сырьем которых служит нефтепродукт. Для обозначения концентрации микропримесей служит единица измерения «ррм» (пэ пэ эм или nu nu эм):
1 ррм (parts per millioп) = 1 м.д. (миллионная доля) = 0,0001 %.
Различают весовые (или массовые), объемные и мольные единицы концентрации, которые специфичны для каждой смеси веществ и не имеют универсальных формул пересчета. Исключение: объемные проценты или ррм для газов равны мольным.
Единицы измерения давления. В российской нефтяной отрасли, как и в некоторых других отраслях промышленности, для измерения давления принято применять кгс/см2 (килограммы силы на сантиметр в квадрате) или технические атмосферы (это то же самое).
Ниже для сведения приведены формулы пересчета этой и других единиц измерения давления.
1 кгс/см2 (килограмм-сила на квадратный сантиметр)= 98066,5 Па;
1 мм вод. ст. (миллиметр водного столба) = 9,80665 Па;
1 мм рт. ст. (миллиметр ртутного столба) = 133,322 Па;
1 бар = 105 Па;
1 ат (техническая атмосфера) = 1 кгс/см2 = 735 мм рт. ст. = 98066,5 Па (ати обозначает избыточное (по сравнению с атмосферным давлением) давление в технических атмосферах, ата - абсолютное давление в технических атмосферах);
1 атм (физическая атмосфера) = 760 мм рт. ст. = 1,0332 кгс/см2 = 101325 Па.
В США в качестве единиц измерения давления применяется специфическая величина - psi (pounds per square inch, фунты на квадратный дюйм)
1 psi = 0,0703 кгс/см2 = 6894,1 Па;
1 кгс/см2 = 14,223 1 psi.
Единицы измерения длины. Длина, также как и масса, измеряется в нефтяной отрасли в тех же величинах, каковы приняты в данной стране. Поскольку многие страны, главная из которых США, не приняли и пока не собираются принимать метрическую систему, здесь также может возникнуть потребность в пересчете величин
1 фут (foot) = 12 дюймов = 30,48 см;
1 дюйм (inch) = 2,54 см.
Единицы измерения массы:
1 фунт (pound, сокр. lb от латинского libra) = 16 унций = 453,6 г;
1 унция (ounce) = 28,35 г;
1 тройская унция (ounce troy) = 31,1035 г.
Единицы измерения температуры. Температура в градусах Цельсия (°С) = температура в Кельвинах (К) - 273,15.
В некоторых зарубежных странах, прежде всего в США, принята шакала Фаренгейта (°F). Для того чтобы перевести температуру, в градусах Фаренгейта в градусы Цельсия нужно из ее значения вычесть 32 и разность умножить на 5/9:
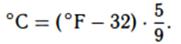
Для перевода градусов Цельсия в градусы Фаренгейта соответственно нужно выполнить обратные действия:
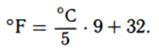
При построении шкалы Фаренгейта температурный интервал от точки кристаллизации до точки кипения воды при атмосферном давлении был принят равным 180 °F. Причем температуру кристаллизации воды (0°С) установили равной 32°F. То есть точка кипения воды (100°С) по шкале Фаренгейта будет равной 212°F. Для быстрого приближенного перевода значения температуры из одной шкалы в другую можно использовать приведённое ниже графическое соотношение двух шкал (рис.3).

Рис. 3. Соотношение температурных шкал Фаренгейта и Цельсия
Шкала Рэнкина подобна шкале Кельвина: нулевая отметка соответствует абсолютному нулю, интервальные значения аналогичны градусам Фаренгейта:
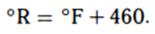
Единицы измерения энергии. В российской нефтяной отрасли в качестве единиц измерения энергии часто используются не входящие в систему «СИ» калории (чаще гигакалории Гкал, кал •109). За рубежом более распространена британская тепловая единица:
1 Дж (Джоуль) = 0,2388459 Кал = 0,0009478 171 BTU = 0,0002777778 Вт · ч = 1 Вт·с;
1 Кал (калория) = 4, 1868 Дж = 0,00396832 1 BTU = 0,001 163 Вт·ч;
1 BTU (Британская тепловая единица) = 251,9958 Кал = 1055,056 Дж = 0,2930711 Вт·ч;
1 Вт·ч = 3600 Дж = 859,8452 Кал = 3,412142 BTU.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 723; Нарушение авторских прав?; Мы поможем в написании вашей работы!