
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Белки пищевого сырья
|
|
|
|
Белки злаков
Анализируя аминокислотный состав суммарных белков различных злаковых культур с точки зрения состава эталонного белка для питания людей (ФАО, 1973) следует отметить, что все они, за исключением овса, бедны лизином (2,2-3,8%), а за исключением риса и сорго - изолейцином. Для белков пшеницы, сорго, ячменя и ржи характерно относительно небольшое количество метионина (1,6-1,7 мг/100 г белка). Белки пшеницы к тому же содержат недостаточное количество треонина (2,6%), а белки кукурузы - триптофана (0,6%). Наиболее сбалансированными по аминокислотному составу являются овес, рожь и рис.
Аминокислотный состав суммарных белков злаковых культур определяется аминокислотным составом отдельных фракций, в основу классификации которых положен принцип растворимости (Т. Осборн, 1907). При последовательной обработке муки или размолотого зерна водой, 5-10%-м раствором хлорида натрия, 60-80%-м водным раствором спирта и 0,1-0,2%-м раствором гидроксида натрия экстрагируются белковые фракции, соответственно названные альбуминами, глобулинами, пролами-нами и глютелинами. В таблице 2.3 приводится процентное содержание белковых фракций в зерновых культурах. В состав белков входят и так
называемые склеропротеины (нерастворимые белки), содержащиеся в оболочках и периферических слоях зерна. Особенностью белков данной фракции является прочное соединение с лигнино-полисахаридным комплексом. Склеропротеины выполняют структурную функцию и малодоступны для пищеварения. Наряду с белками в зерне содержится небелковый азот (0,7-12,9% от общего азота), включающий свободные аминокислоты (50-60%), пептиды, нуклеотиды и др. Количество небелкового азота-изменяется в зависимости от степени зрелости, выравненнос-ти и прорастания зерна.
Таблица 2.3. Содержание белковых фракций в зерне злаковых
| Культура | Азот фракций (в % от белкового азота) | ||||
| Альбумины | Глобулины | Проламины | Глютелины | Склеропротеины | |
| Пшеница мягкая | 5,2 | 12,6 | 35,6 | 28,2 | 8,7 |
| Рожь | 24,5 | 13,9 | 31,1 | 23,3 | 7,2 |
| Ячмень | 6,4 | 7,5 | 41,6 | 26,6 | 17,9 |
| Кукуруза | 9,6 | 4,7 | 29,9 | 40,3 | 15,5 |
| Овес | 7,8 | 32,6 | 14,3 | 33,5 | 11,8 |
| Гречиха | 21,7 | 42,6 | U | 12,3 | 23,3 |
| Рис | 11,2 | 4,8 | 4,4 | 63,2 | 16,4 |
Для альбуминов отличительной особенностью является высокое содержание лизина (3,9-8,2%), треонина (2,4-7,7%), метионина (1,7- 3,3%), изолейцина (3,1-6,0%) и триптофана (6,7-16,9%). Наиболее высоким содержанием лизина отличаются альбумины овса, риса и проса (6,5-8,2%), более низким - альбумины пшеницы, ячменя и ржи (3,9-4,5%). Высокое количество треонина (4,7-7,7%) характерно для альбуминов ячменя, ржи, овса; низкое (2,4%) - для альбуминов пшеницы.
Глобулиновая фракция злаковых культур беднее, чем альбуминовая по содержанию лизина (2,8-6,0%), триптофана (0,5-1,3%) и метионина (1,1-2,7%). Обе фракции отличаются высоким содержанием глютами-новой и аспарагиновой кислот, но низким - пролина.
Характерной особенностью проламинов является высокое содержание остатков глутаминовой кислоты (13,7-43,3%), пролина (6,3-19,3%) и малое количество ионогенных групп, так как дикарбоновые кислоты почти полностью амидированы. Проламины отличаются низким содержанием лизина. Очень мало его в зеине кукурузы (0,2%), глиадине пшеницы и секалине ржи (0,6-0,7%). Высокий процент лизина (3,3%)
наблюдается в авенине овса. Небольшое количество лизина в проламинах и относительно большое содержание данной фракции в суммарном белке отражается на общей несбалансированности зерна большинства злаковых культур. Проламины бедны к тому же треонином, триптофаном, аргинином и гистидином. Зеин кукурузы, оризин риса и кафирин сорго отличаются высоким уровнем лейцина (16,9-18,6%). По содержанию цис-тина и метионина среди отдельных злаков также наблюдаются различия. Так, глиадин пшеницы в среднем содержит 1,2% метионина и-1,9% цис-тина, а авенин овса - 3,7 и 4,2%, соответственно.
Глютелины по аминокислотному составу занимают промежуточное положение между проламинами и глобулинами. Содержание лизина, аргинина, гистидина в них больше, чем в проламинах. Так, содержание лизина в глютенине пшеницы составляет 2,6%, ржи - 2,3%, ячменя - 4,0%, а овса - 5,0%. По содержанию лизина и цистина между сортами зерна наблюдаются некоторые различия. Например, глютенин пшеницы слабого сорта Акмолинка 1 содержит меньше цистина (5,18%), чем глютенин сильного сорта Саратовская 29 (7,34%). Глютелины ячменя, риса и овса отличаются от глютенина пшеницы более высоким уровнем лизина. Если учесть, что у риса 80% всего белка приходится на глютелины (оризенин), то понятно, почему обеспечивается удовлетворительное содержание лизина (2,6-4,0%) в общем белке рисового зерна. Преобладающими фракциями овса являются глобулины и глютелины, содержащие 5,0-5,5% лизина, что также обеспечивает хорошую сбалансированность данной культуры по лизину.
Белки неравномерно распределяются между морфологическими частями зерна. Основное их количество (65-75%) приходится на эндосперм, меньшее - на алейроновый слой (до 15,5%) и зародыш (до 22%). В алейроновом слое и зародыше концентрация белка высокая^ В зародыше пшеницы содержится 33,3% белка, кукурузы - 26,5%, овса - 19,4%. Алейроновый слой пшеницы и кукурузы содержит более 19% белка. В эндосперме белки распределены также неравномерно, концентрация их снижается по мере продвижения от субалейронового слоя к центру. Субалейроновым слоем называется периферическая зона зерновки, находящаяся под алейроновым слоем. Содержание белка в данной части зерна достигает у кукурузы 27,7%, у сорго 29-30%, у ячменя 21-24%, у риса 29%. Центральная часть эндосперма содержит мало белка (7-9%). В общем же распределение белка по частям зерновки зависит от вида культуры, ее сорта и почвенно-климатических условий выращивания.
Белки зародыша и алейронового слоя представлены в основном альбуминами и глобулинами, выполняющими каталитическую функцию при прорастании зерна (ферменты), а белки эндосперма - альбуминами, глобулинами, проламинами и глютелинами. Большую часть белков
эндосперма злаковых культур (до 80%) составляют запасные белки: спирторастворимые проламины и щелочерастворимые глютелины. Альбумины и глобулины входят в состав мембран органелл зерна, образуют рибосомы, митохондрии, эндоплазматический ретикулум, являются составной частью сложных белков - нуклеопротеидов, липопротеи-дов, фосфопротеидов.
Запасные белки эндосперма злаков сосредоточены в белковых телах, имеющих более простое строение, чем алейроновые зерна (белковые тела алейронового слоя). Алейроновое зерно состоит из кристаллоида (гли-копротеида), глобоида (калиевой, магниевой соли фитиновой кислоты) и основного белкового вещества - аморфной зоны.
У кукурузы и сорго белковые тела эндосперма состоят из матрицы и вдавленных в нее округлых белковых гранул. Матричные белки являются глютелинами, а белки гранул - проламинами. Матричный белок характеризуется однородной структурой, тогда как белковые гранулы имеют пластинчатую структуру с входящими в нее липопротеинами. В эндосперме зрелого зерна пшеницы откладываются белковые образования в виде непрерывной белковой матрицы клиновидной формы и в виде выпуклых серповидных зон под мембраной, окружающей крахмальные зерна. С этими представлениями соотносится классификация Гесса (Hess, 1954), по которой белки муки разделяются на промежуточные (цвикель) и прикрепленные (хафт). Промежуточные белки располагаются между крахмальными зернами и соответствуют белковой матрице, а прикрепленные представляют собой остатки мембран крахмальных зерен. У ржи и пшеницы прикрепленные белки характеризуются лучшим аминокислотным составом. При размоле твердых и стекловидных мягких пшениц раскол компонентов происходит через крахмальное зерно и запасной белок, в результате чего крахмальные зерна разрушаются. При размоле зерна с мучнистым эндоспермом трещины образуются не в крахмальных зернах, а вокруг них, так как между белком и крахмалом существует относительно слабое взаимодействие.
Белковые фракции зерновых культур представляют собой гетерогенную смесь отдельных компонентов, сходных по ряду физико-химических свойств. В то же время компоненты отличаются по электрофорети-ческой подвижности, молекулярной массе, аминокислотному составу и способности взаимодействовать друг с другом при помощи различных типов связей. В альбуминах мягкой пшеницы электрофорезом в ПААГ и крахмальном геле обнаружено 14-21 субъединиц, преобладающими среди которых по количеству являются субъединицы с молекулярной массой около 11 и 20 кД. Эти компоненты различаются по содержанию лизина, аланина, триптофана и гистидина, они отсутствуют в твердой пшенице.
В эндосперме мягкой пшеницы обнаружены доминирующие ос-глобулины с молекулярной массой 24 кД, в зародыше - γ-глобулины с молекулярной массой 210 кД. К глобулинам относят и специфические белки, выделенные в кристаллической форме из бензинового экстракта муки (пуротионин пшеницы, гордотионин ячменя). В зерне они содержатся в виде липопротеинового комплекса, имеют молекулярную массу около 7 кД. Положительного влияния этих белков на хлебопекарные свойства муки не установлено.
С помощью ионообменной хроматографии, гельхроматографии, электрофореза и других методов глиадиновая фракция пшеницы разделена на большое число индивидуальных компонентов. Электрофоретические компоненты глиадина условно объединяют в порядке уменьшения электрофорети-ческой подвижности в кислой среде в четыре группы: α-, β-, γ- и ωглиадины, каждая из которых состоит из нескольких компонентов. Общее число белковых компонентов в пшенице может достигать 40-50. При строго определенных условиях электрофореза в ПААГ или крахмальном геле электрофоретический спектр рассматривается как генотипический признак вида и сорта пшеницы (рис. 2.13). Эталонный спектр содержит 30 позиций, которые распределяются по фракциям следующим образом:

Рис. 2.13. Эталонный электрофоретический спектр глиадина пшеницы [В. Конарев, 1983]
В соответствии с этим эталоном глиадин сорта Лютесценс 230, например, записывается так:
α 567 β 2345 γу2345 ω34689
Большинство глиадиновых белков построено из одной полипептидной цепи с молекулярной массой 30-45 кД и внутримолекулярными ди-сульфидными связями (рис. 2.14). В меньшем количестве в состав глиадина
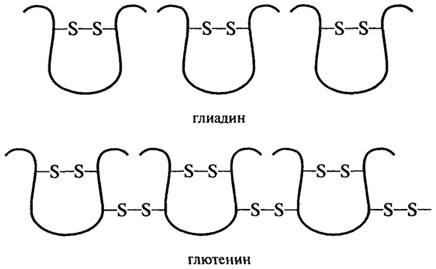
Рис. 2.14. Дисульфидные связи в глиадине и глютенине
входят белки с молекулярной массой 22; 25,6; 48,8; 57,3 кД и 64-80 кД, а также димеры, построенные из одноцепочных молекул главного типа (36,5 и 44,2 кД). От других компонентов в большей степени отличаются ω-глиадины, имеющие слабый заряд, высокое содержание глутамина, глу-таминовой кислоты, пролина, гидрофобных остатков аминокислот и не содержащие цистина и метионина и, соответственно, внутримолекулярных дисульфидных связей. В питательном отношении со-глиадины являются ценными как источники -NH2 групп и пролина, необходимых для биосинтеза аминокислот и азотистых оснований. Дополнительно в состав глиадина входят низкомолекулярные белки (5-10%) типа альбуминов, глобулинов (11-12 кД) и высокомолекулярная фракция ("низкомолекулярный глютенин") с молекулярной массой 104-125 кД (6%).
Проламины других злаков также образуют индивидуальные электро-форетические спектры, поэтому, как и у пшеницы, они используются в роли белковых маркеров для определения видовой и сортовой принадлежности при выведении новых сортов, основываясь на зависимости ценных хозяйственных признаков зерна (урожайность, засухоустойчивость, неспособность к полеганию и др.) от присутствия конкретных компонентов.
Глютенин пшеницы является более гетерогенной белковой фракцией по сравнению с глиадином. Он состоит из многих компонентов с молекулярной массой от 50 до 3000 кД и без разрыва дисульфидных связей не способен мигрировать в гель при электрофорезе. Восстановленный глютенин разделяется при электрофоретическом анализе не менее чем на 15 компонентов, состоящих из одной полипептидной цепи с молекулярными массами от 11,6 до 133 кД. Некоторые из них идентичны молекулам глиадина (36-44,6 кД), другие - молекулам альбуминов и глобулинов (11,6 кД), а третьи представляют собой специфические высокомолекулярные субъединицы (102, 124, 133 кД). Эти данные позволяют
утверждать, что глютенин - это белок, построенный из многих полипептидных цепей, соединенных между собой дисульфидными связями. Расчеты показывают, что на каждую полипептидную цепь глютенина приходится 2-3 дисульфидные связи с соседними цепями (Эварт, 1968).
Изучению запасных белков, особенно глютенина, отводится важная роль, однако структура их остается до конца не выясненной. Главной трудностью при выяснении особенностей строения является способность белков к агрегации, которую трудно преодолеть известными в настоящее время методами. До сих пор изучаются значения молекулярных масс компонентов и целого белка этой фракции. Так, по последним данным отечественных ученых, глютенин состоит из белковых частиц, включающих несколько субъединиц с молекулярной массой всего 100-300 кД, тогда как на долю частиц сверхвысокой молекулярной массы и одноцепочных молекул приходится не более 20%.
Предложены несколько гипотез строения глютенина и клейковины, однако ни одна из них не дает полного ответа на вопросы взаимосвязи его особенностей с природой вязко-эластичных свойств пшеничного теста. До конца не выяснен вопрос, чем отличаются глютелины зерновых культур, способных и не способных к формированию клейковинного комплекса. По представлениям Эверта, это различие обусловлено неодинаковым способом соединения отдельных полипептидных цепей через дисульфидные мостики при образовании полимерных молекул глю-телинов. Каждая полипептидная цепь, соединяясь с другими, может увеличиваться в длину, образуя структуру линейного типа. Если же полипептидные цепи соединяются большим количеством поперечных ди-сульфидных мостиков, то возникает разветвленная трехмерная структура, обладающая относительно высокой компактностью. Глютелины зерновых культур, образующих клейковину, обладают линейной структурой в отличие от глютелинов культур, не способных формировать ее (овес, кукуруза).
Реологические свойства клейковины и теста получают более полное обоснование, если принять линейную структуру глютенина, тогда и вязкость теста из пшеницы, ржи и ячменя можно объяснить сильным раскручиванием достаточно гибких цепей и постоянным перемещением их относительно друг друга. Свойство эластичности возникает вследствие тенденции растянутых, незакрученных полипептидных цепей возвратиться к их прежней конформации. Причиной же отсутствия вязко-эластичных свойств овсяного и кукурузного теста является ветвящийся способ соединения полипептидных цепей, характеризующийся трехмерной разветвленной структурой.
Во всем мире интенсивно проводятся исследования, посвященные зависимости хлебопекарных качеств пшеницы от полипептидного состава
глютениновой фракции в связи с различиями сортов и классов на генетическом уровне. Установлено, что наиболее выраженное влияние на реологические свойства клейковины и качество хлеба оказывает присутствие высокомолекулярных субъединиц глютенина (100 кД) или соотношение высоко- и низкомолекулярных субъединиц. Всего обнаружено около 25 субъединиц с высокой молекулярной массой, 3-5 из них присутствует в каждом сорте. Каждой субъединице присвоен номер в зависимости от подвижности в ПААГ с ДДС-Na, и выясняется конкретная роль ее в обеспечении качества зерна. Например, 98% американских сортов пшеницы, характеризующиеся высокой "силой" и хорошей эластичностью теста, содержат субъединицы 5+10, синтез которых кодируется хромосомой 1Д, тогда как у английских пшениц с низким качеством они встречаются только у 19% образцов. Такая же картина наблюдается и в отношении высокомолекулярных субъединиц 7+8 и 7+9, кодируемых хромосомой В1.
Реологические свойства клейковины и качество пшеничного хлеба зависят не только от присутствия высокомолекулярных субъединиц (60%), но и от наличия хромосомы 1BL/1RS (7%), полиморфизма низкомолекулярного глютенина, глиадина (а-, Р-, у-, со-), количества белка и активности а-амилазы (31%). Глютенин придает клейковине упругие свойства, а глиадин обуславливает растяжимость и связность, то есть ни глютенин, ни глиадин в отдельности не обладают характерными реологическими свойствами клейковины, только взаимодействие этих фракций в едином комплексе создает клейковинный белок со всеми присущими ему особенностями. Предполагают, что "полипептидные цепи глиадина в разных местах и разными связями соединяются с полимеризо-ванными молекулами глютениновой фракции, объединяя их в сложную трехмерную сетку переплетающихся полипептидных цепей" (А. Вакар, 1975). В структуре такой сетки значительную роль помимо ковалентных дисульфидных связей играют нековалентные взаимодействия: водородные, электростатические (ионные) связи и гидрофобное взаимодействие. Всем им отводится важная роль при объяснении различий в реологических свойствах крепкой и слабой клейковины (растяжимости, связности, упругости, эластичности).
Аминокислотный состав клейковинного белка и соотношение глиа-диновой и глютениновой фракций не являются показателями его качества, тогда как растворимость, содержание водородных, дисульфидных связей и вискозиметрические характеристики соотносятся с различиями реологических характеристик клейковины. Крепкая клейковина отличается от слабой меньшей растворимостью в разных растворителях, большим количеством водородных и дисульфидных связей, меньшими значениями характеристической вязкости (η), удельного
гидродинамического объема и осевого отношения частиц (в/а). Частицы крепкой клейковины имеют уплотненную структуру, слабой - разрыхленную.
Более высокая скорость агрегации белков клейковины хорошего качества при действии на них солей свидетельствует о большей роли гидрофобных взаимодействий в структуре крепкой клейковины по сравнению со слабой. Установлен больший вклад этих видов взаимодействий в агрегацию глютенина и его фракций. Для упругой, эластичной клейковины на долю белков глютенина, перешедшего в раствор за счет разрыва гидрофобных связей, приходится 25,4%, ионных- 17,3%, водородных - 56,3%, в то время как для неупругой и растяжимой клейковины распределение белка по растворимости составляет, соответственно, 7,1; 12,8 и 80,1 %. Излишняя "гидрофобизация" поверхности белковых молекул (действие жирных кислот, тепловая денатурация и т.д.) приводит к ухудшению реологических свойств клейковины (связности), снижению гидратации и растворимости. Таким образом, разная степень упругости, растяжимости и связности определяется различным соотношением сил ковалентного и нековалент-ного характера (гидрофобные, ионные, водородные связи) как внутри фракций клейковины, так и на уровне взаимодействия их друг с другом.
Признавая за глиадином и глютенином главенствующую роль в обеспечении качества клейковины, необходимо учитывать роль небелковых соединений в формировании ее структуры. Высокая реакционная способность химических группировок молекул белка делает возможным взаимодействие их с липидами и углеводами и образование, соответственно, липопротеиновых и гликопротеиновых комплексов, оказывающих влияние на структуру и свойства клейковины. Общепризнана гипотеза, по которой фосфолипиды являются составной частью липопротеина, выполняющего роль слоистой структуры между белковыми пластинками и обеспечивающего деформацию скольжения (Гросскрейтц, 1960). В целом же особенности взаимодействия белков и других веществ зерна остаются до конца не изученными.
С клейковинным комплексом пшеницы находятся во взаимодействии протеазы, их белковые ингибиторы, амилазы и липоксигеназа (табл. 2.4). Протеазы извлекаются щелочным раствором соды, р-амилаза - водным
Таблица 2.4. Ферментативная активность белков клейковины [М. Попов, 1998]
| Растворитель | Растворенный белок, % | Активность ферментов, ед/r клейковины | ||
| Протеазы | Липоксигеназа | β-Амилаза | ||
| Сода 0,35%-я Спирт 70%-й Глугатион 0,75%-й | 23,3 49,1 92,7 | 5,94 0 0 | 0 0 780 | 0 1560 9835 |
раствором спирта, а липоксигеназа и β-амилаза - раствором глютатио-на. В покоящемся зерне ферменты не проявляют своей активности, тогда как при прорастании они участвуют в распаде и превращениях запасных питательных веществ. Не менее важная роль отводится ферментам и при тестоведении. Протеазы, частично дезактивируя белки, ослабляют клейковину, липоксигеназа, при участии которой продукты окисления жирных кислот окисляют -SH группы белка, укрепляет ее. Высвобождение липоксигеназы из клейковины происходит в присутствии восстановленного глютатиона, с другой стороны, это же соединение, принимая участие в тиоловом обмене с клейковиной, уменьшает количество S-S связей и ослабляет ее. Таким образом, ферментные системы в комплексе с клейковинными белками выступают в роли регулятора качества хлеба из пшеницы.
Среди злаковых культур особого внимания заслуживает белковый комплекс первой искусственно созданной зерновой культуры, полученной
Таблица 2.5. Аминокислотный состав белков муки (в г на 100 г белка)
| Аминокислота | Яровая рожь | Тритикале | Твердая пшеница |
| Лизин | 3,49 | 2,80 | 2,29 |
| Гистидин | 2,14 | 2,34 | 2,37 |
| Аргинин | 4,55 | 4,77 | 3,64 |
| Аспарагиновая кислота | 6,82 | 5,67 | 4,62 |
| Треонин | 3,26 | 3,05 | 2,82 |
| Серии | 4,11 | 4,37 | 4,37 |
| Глутаминовая кислота | 30,51 | 32,91 | 35,78 |
| Пролин | 15,29 | 14,18 | 13,92 |
| Глицин | 3,82 | 3,87 | 3,52 |
| Алании | 4,06 | 3,55 | 3,27 |
| Цистин | 2,65 | 3,22 | 2,66 |
| Валин | 5,22 | 4,93 | 4,77 |
| Метионин | 2,15 | 2,25 | 2,14 |
| Изолейцин | 4,21 | 4,37 | 4,51 |
| Лейцин | 6,65 | 7,55 | 7,46 |
| Тирозин | 2,16 | 2,81 | 2,67 |
| Фенил аланин | 5,16 | 4,98 | 5,48 |
| Аммиак | 3,40 | 3,25 | 3,91 |
при скрещивании пшеницы (Triticum) и ржи (Secale) - тритикале. С точки зрения питательности тритикале - ценная культура, так как ее отличает относительно высокий уровень белка (11,7-22,5%) и улучшенный аминокислотный состав по сравнению с пшеницей. Аминокислоты в тритикале содержатся, как правило, в количествах, промежуточных между родительскими формами (табл. 2.5). Более высокое содержание лизина, метионина и других аминокислот существенно для пищевой ценности. В данной культуре геномы ржи и пшеницы не взаимодействуют между собой с образованием "новых" белков, поэтому их электрофореграммы являются идентичными электрофореграммам смеси белков родительских форм.
По сравнению с пшеницей тритикале содержит больше водорастворимых и солерастворимых белков, но меньше - спирторастворимых и значительно меньше - белков нерастворимого остатка, поэтому в хлебопечении она может использоваться только в смеси с пшеничной мукой или с улучшителями.
56:: 57:: 58:: 59:: 60:: 61:: 62:: 63:: 64:: 65:: 66:: Содержание
66:: 67:: 68:: 69:: 70:: 71:: 72:: Содержание
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 393; Нарушение авторских прав?; Мы поможем в написании вашей работы!