
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Газы, применяемые при тушении
|
|
|
|
Наряду с токсичными и вредными продуктами горения загрязнение окружающей среды может быть вызвано огнетушащими веществами, используемыми в пожаротушении.
Известно разрушающее действие фреонов на озоновый слой. Некоторые галогеноуглероды (например, фреон 13В1, 114В2) особенно опасны, так как способны долгое время находиться в атмосфере и эффективнее других взаимодействуют с озоновым слоем на больших высотах.
Поверхностно - активные вещества (ПАВ), применяемые в пожарной охране как смачиватели и пенообразователи, также причиняют вред окружающей среде. Попадая в водоемы, они препятствуют поступлению кислорода. Многие ПАВ биологически трудно разлагаются (ПО-1, ПО-10, Форэтол, ПО-6К). В результате происходит гибель фитопланктона, рыб.
В качестве огнетушащих веществ для тушения используются газы, перечень которых определен в Своде правил СП 5.13130.2009 «Установки пожарной сигнализации и пожаротушения автоматические» (пункт 8.3.1).
Это следующие газовые огнетушащие вещества: хладон 23, хладон 227еа, хладон 125, хладон 218, хладон 318Ц, азот, аргон, инерген, двуокись углерода, шестифтористая сера.
Применение газов, которые не входят в указанный перечень, разрешается только по дополнительно разработанным и согласованным нормам (техническим условиям) для конкретного объекта.(Свод правил СП 5.13130.2009 «Установки пожарной сигнализации и пожаротушения автоматические»
Нейтральные газы - это разбавляющие атмосферу газы. К ним относятся такие сжатые газы, как аргон, азот, углекислый газ.
Диоксид углерода находится в баллонах в сжиженном состоянии и может применяться для тушения в газообразном или снегообразном состоянии в виде хлопьев температурой около –70° С. В газообразном состоянии он применяется для тушения пожаров в закрытых помещениях, в снегообразном виде — для тушения загораний с небольшой зоной горения, главным образом в первичных средствах пожаротушения. При тушении пожара в закрытом помещении огнетушащая концентрация диоксида углерода в воздухе помещения составляет примерно 30 % об. При таких концентрациях она может вызвать отравление людей, находящихся в помещении, где произошел пожар.
При высоких концентрациях углекислого газа увеличиваются частота и глубина дыхания. Особенно резко возрастает вентиляция легких при совершаемой в условиях гиперкапнии мышечной работе: в 10—12 раз и более. Это далеко не безразлично для организма человека, возникают сложные, а часто и парадоксальные реакции. При очень больших концентрациях углекислого газа во вдыхаемом воздухе происходит сужение бронхов, а при концентрации выше 15% — спазм голосовой щели.
Изменения состава крови при длительной гиперкапнии заключаются в увеличении числа эритроцитов, лейкоцитов и содержания гемоглобина, увеличении вязкости крови, мобилизации форменных элементов из кровяных депо. В дальнейшем эти механизмы существенно угнетаются. Происходит уменьшение содержания сахара в крови, снижается утилизация глюкозы. Наблюдается уменьшение гликогенных запасов печени, снижение содержания гликогена в мозгу. Снижается содержание кальция в крови, и усиливается деминерализация костей, тормозится белковый обмен и ресинтез макроэргических фосфорных соединений. Особенно значительно уменьшается содержание АТФ в мозговой ткани. Повышение содержания углекислоты во вдыхаемом воздухе сначала вызывает учащение сердцебиения, затем, наоборот, — брадикардию. В связи с увеличением вязкости крови значительно увеличивается и нагрузка на сердце.
Аргон – газ без цвета и запаха. При охлаждении до температур жидкого азота и жидкого аргона многие материалы становятся хрупкими.
Аргон тяжелее воздуха и может скапливаться в приямках, колодцах, тупиках, вытесняя при этом воздух. Содержание кислорода может снижаться ниже предельных величин. Выравнивание концентрации за счет диффузии происходит медленно и зависит от объемов, геометрических форм, притока аргона в атмосферу, его температуры. Температура азота или аргона имеет большое значение. Так, несмотря на то, что азот легче воздуха, он, как и аргон может скапливаться в приямках и колодцах, если температура поступающего азота ниже температуры воздуха.
Азот – газ без цвета и запаха. На предприятиях черной металлургии используется азот чистой 95-97%; азот чистый с содержанием примесей менее 0,01% и азот жидкий чистотой более 99%.
При испарении жидкого азота, содержащего небольшое количество кислорода, в первую очередь испаряется азот, в результате чего концентрация кислорода в жидкости увеличивается и может достигнуть значений, при которых возникает опасность загорания и взрыва в ней ряда веществ и материалов.
Аргон и азот – физиологически инертные, нетоксичные газы. Замещая кислород в воздухе и вытесняя собой кислород из организма, они воздействуют на человека как удушающие агенты (асфиксанты) по причине снижения парциального давления кислорода.
При медленном снижении содержания кислорода в атмосфере до непродолжительно переносимого организмом уровня (5-7%) обнаруживаются симптомы:
- учащение дыхания и пульса, ритм дыхания может быть волнообразным (периоды учащения дыхания сменяются периодами замедления);
- потеря равновесия, головокружение, возможна эйфория;
- чувство тяжести или сдавливания в лобной части головы;
- стук в висках;
- чувство жара во всем теле;
- чувство покалывания в языке, кончиках пальцев рук и ног;
- затруднение речи;
-прогрессивно (возможно быстро) снижающаяся физическая работоспособность, нарушение координации;
- изменение восприятия окружающей обстановки и угнетение функции органов чувств, особенно осязания;
- возможны «провалы» памяти и потеря сознания.
Симптомы могут появляться в зависимости от индивидуальной предрасположенности человека к действию гипоксии.
При резком снижении содержания кислорода в атмосфере и, особенно при случайном попадании человека в среду азота или аргона достаточно нескольких вдохов для снижения парциального давления кислорода в крови до критического уровня – наступает потеря сознания, практически всегда внезапно.
Разницы в воздействии на человека аргона или азота при полном вытеснении ими из атмосферы кислорода не существует.
При вдыхании гипоксической, но переносимой организмом, смеси воздуха с аргоном в отличие от азота индивидуально может проявляться слабое наркотическое действие аргона, выражающееся небольшой эйфорией. Но принципиального значения относительно угрожающей опасности это не имеет.
Задание 2. Расчет срока исчерпания невозобновимых ресурсов
Оцените срок исчерпания природного ресурса, если известен уровень добычи ресурса в текущем году, а потребление ресурса в последующие годы будет возрастать с заданной скоростью прироста ежегодного потребления. Сделайте вывод о последовательности прекращения добычи ресурсов.
Дано:
| Вид ресурса | Запас ресурса, Q, млрд.т | Добыча ресурса q, млрд.т/год | Прирост объема потребления ресурса, ТР, % в год |
| Уран | 0,3 | 2,5 |
Решение:
Для расчета запаса ресурсов используют формулу суммы членов ряда геометрической прогрессии:

Логарифмирование выражения для Q дает следующую формулу для расчета срока исчерпания ресурса:
 ,
,
где Q – запас ресурсов; q – годовая добыча ресурса;
ТР – прирост потребления ресурса; t – число лет.
t = ln (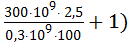 / ln (
/ ln ( ) = ln(25) / ln(1,025) = 130,4 лет
) = ln(25) / ln(1,025) = 130,4 лет
Ура́н — химический элемент с атомным номером 92 в периодической системе, атомная масса — 238,029; обозначается символом U (лат. Uranium), относится к семейству актиноидов. При нормальных условиях — металл. Уран — слаборадиоактивный элемент, он не имеет стабильных изотопов. Самым распространенным изотопом урана является уран-238 (имеет 146 нейтронов, составляет 99,3 % из всего урана в природе) и уран-235 (143 нейтрона, 0,7 % всего урана, найденного в природе).
Если не снизить скорость и объем добычи и потребления урана, то через пару сотен лет он исчерпает все свои ресурсы, и это станет большой проблемой так как он используется как ядерное топливо, так же он необходим в геохронологии, а так же для радиационной защиты и производства энергии.
Задание 3. Расчет количеств потребляемых и выделяемых веществ в процессе функционирования лесных экосистем
Определить массы потребляемых СО2 и Н2О и выделяемого О2 при создании годового прироста древесины V год. Элементный состав древесины и ее плотность приведены в таблице.
Дано:
| Элементный состав, % | Плотность, кг/м3 | V год., м3/га∙год | ||
| С | Н | О | ||
| 50,4 | 6,0 | 43,6 | 5,5 |
Решение:
1) Процесс функционирования лесных экосистем можно записать в виде уравнения:
xCO2 +  H2O CxHyOz + wO2 , где
H2O CxHyOz + wO2 , где
x =  ; y =
; y = 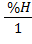 ; z =
; z =  (коэффициенты уравнения)
(коэффициенты уравнения)
Найдём эти коэффициенты:
x =  = 4,2; y = 6,0; z =
= 4,2; y = 6,0; z = 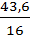 = 2,7
= 2,7
2) Для кислорода, коэффициент уравнения можно найти из выражения:
2x + 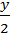 = z + 2w => w = x +
= z + 2w => w = x +  +
+ 
W = 4,2+ 6,0/4 + 2,7 /2 = 7,05
3) Для того, чтобы вычислить количество поглощенных СО2, Н2О и выделяемого О2 необходимо воспользоваться формулами:
NСО2 =  × MCO2 × Mдрев
× MCO2 × Mдрев
NH2O =  × MH2O × Mдрев
× MH2O × Mдрев
NO2 =  × MO2 × Mдрев,
× MO2 × Mдрев,
где МСО2, МН2О, МО2 – молярная масса СО2, Н2О, О2 соответственно; Мдрев – абсолютно сухой вес всего объема древесины.
Пересчет объемов древесины на абсолютно сухой вес производят по формуле:
Мдрев = р × Vгод ,
где р – плотность древесины, Vгод - объем годового прироста древесины.
Мдрев = 570 × 5,5 = 3135 кг
Найдем количество поглощенных СО2, Н2О и выделяемого О2:
MСО2 = 0,042× 44 × 3135 = 5793 кг
MH2O = 0,03× 18 × 3135 = 1693 кг
MO2 = 0,0705× 32 × 3135 = 7073 кг
Задание 4. Расчет газовых выбросов при сжигании топлива
Составьте материальные балансы веществ при сжигании различных видов топлива, для данного количества и состава.
Дано:
| Вариант | Масса, тыс. тонн | Состав топлива, % |
| природный газ | СН4 – 68, С3Н8 – 17, С4Н10 – 12, СО2 – 3 |
Решение:
Уравнение горения топлива:
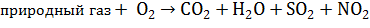
1) Составим уравнения продуктов горения химических элементов, входящие в состав данного вида топлива:
- Реакция горения метана:

Стехиометрическое соотношение по весу:


- Реакция горения пропана:
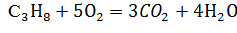
Стехиометрическое соотношение по весу:
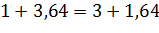
- Реакция горения бутана:
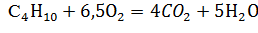
Стехиометрическое соотношение по весу:

2) Рассчитаем массу O2 по формуле:
МО2 = (4 ×  + 3,64 ×
+ 3,64 ×  + 3,58 ×
+ 3,58 × 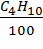 ) × Mтопл
) × Mтопл
МО2 = (4 ×  + 3,64 ×
+ 3,64 ×  + 3,58 ×
+ 3,58 ×  ) × 196000 = 738606 тонн
) × 196000 = 738606 тонн
3) Рассчитаем массу продуктов горения:
МСО2 = (2,75 ×  + 3 ×
+ 3 ×  + 3,03 ×
+ 3,03 × 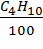 ) × Mтопл = (1,87+0,51+0,3636) × 196000= 537745 тыс. тонн
) × Mтопл = (1,87+0,51+0,3636) × 196000= 537745 тыс. тонн
МH2О = (2,25 ×  + 1,64 ×
+ 1,64 ×  + 1,55 ×
+ 1,55 × 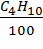 ) × Mтопл = (1,53+0,2788+0,186) × 196000= 390980 тонн
) × Mтопл = (1,53+0,2788+0,186) × 196000= 390980 тонн
Для проверки правильности расчета количества веществ, участвующих в процессе горения данного вида топлива, в соответствии с законом сохранения масс, должно выполняться равенство:
Mтопл + МО2 = МСО2 + МH2О
196000 + 738606 = 537745+390980
934606 тонн = 928725 тонн
Значит, все расчеты верны.
Задание 5. Расчет газовых балансов урбанизированных территорий
Определить количество расходуемого кислорода и СО2, образующегося при сжигании топлива. Период времени Т=1 год. Какая площадь древесных насаждений (или годовой прирост древесины) необходима для поддержания баланса в биотехноценозе?
Дано:
| Вар. | Количество топлива и характеристики древесины |
| 184 тыс. т мазута с элементным составом, %: С – 88, Н – 10, О – 0,5, N – 1, S – 0,5. состав древесины ели, %: С – 50,6, Н – 6,2, О – 43,2, плотность равна 430 кг/м3, годовой прирост 11,1 м3/га |
Решение:
Уравнение горения топлива:

1) Составим уравнения горения основных компонентов топлива:
- Реакция горения углерода:

Стехиометрическое соотношение по весу:
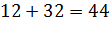

- Реакция горения водорода:
2Н2 + О2 = 2Н2О
Стехиометрическое соотношение по весу:


- Реакция горения азота:
N2 + О2 = 2NO
Стехиометрическое соотношение по весу:


- Реакция горения серы:
S + О2 = S 
Стехиометрическое соотношение по весу:

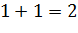
2) Масса кислорода ( , необходимая для сжигания топлива:
, необходимая для сжигания топлива:

где:  - масса сжигаемого топлива;
- масса сжигаемого топлива;
Вычислим  :
:
 581,624 тыс. тонн
581,624 тыс. тонн
3) Количество образующихся основных продуктов сгорания:

4) Масса органического вещества, которая должна быть создана для поглощения СО2 определяется по формуле:
Морг. вещ.погл.СО2 = МСО2 / 0,44 × x,
где x =  (из уравнения процесса функционирования лесных экосистем)
(из уравнения процесса функционирования лесных экосистем)
МСО2 = (3,67 ×  ) × Mтопл =
) × Mтопл = 

Морг. вещ.погл.СО2 = 594,246 / 0,44 × 4,22 = 320,0377 тыс. тонн
5) Массу органического вещества, которая должна быть создана для компенсации количества  , пошедшего на горение топлива, рассчитаем по формуле:
, пошедшего на горение топлива, рассчитаем по формуле:

где:
 - коэффициент уравнения фотосинтеза для древостоев.
- коэффициент уравнения фотосинтеза для древостоев.
Найдем  аналогично заданию № 3.
аналогично заданию № 3.
Уравнение фотосинтеза:
 CO2 +
CO2 +  H2O → CxHyOz +
H2O → CxHyOz +  O2
O2

Определим коэффициент  :
:


Вычислим 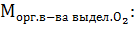

6) Для поддержания баланса в биотехценозе из двух величин массы вещества древесины нужно выбрать наибольшую, обеспечивающую оба газовых баланса одновременно:
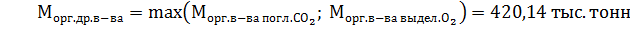
7) Для дальнейшего анализа необходимо пересчитать величину абсолютно сухой массы вещества древесины в объем:

где: 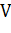 - общий объем древесины,
- общий объем древесины, 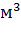 ;
;
Р – базисная плотность древесины соответствующей породы,  ;
;
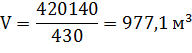
8) На основе величины V и площади леса найдем среднего годового прироста древесины на одном гектаре  :
:
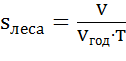 =
= 
Задание 6. Определение размера вреда, причиненного окружающей среде загрязнением атмосферного воздуха в результате пожаров
| Горючее вещество | Плотность горючего вещества ρ, т/м3 | Коэффициент полноты горения β | Площадь пожара S, м2 | Глубина выгорания h, м | Время пожара t | Исходная масса горючего М0, т |
| нефть | 0,9 | - | 0,15 | - | - |
| Загрязнение вещества | Параметры | ||

| Такса H | 
| |
| Взвешенные вещества | 1,7×10-1 | 96000,0 | |

| 2,78×10-2 | 94000,0 | 2613,2 |
| CO | 8,4×10-2 | 62000,0 | |

| 6,9×10-3 | 92000,0 | 634,8 |
| Углеводороды | - | 92000,0 | |
| Вещества 1 класса опасности | 7,8×10-8 | 656000,0 | 0,051 |
| Другие вещества | 1,6×10-2 | 61000,0 | |
| Размер вреда | 25752,051 |
 ρ
ρ 
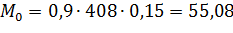 т
т
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 2052; Нарушение авторских прав?; Мы поможем в написании вашей работы!