
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислотно-основна класифікація аніонів
|
|
|
|
Кислотно-основна класифікація катіонів
| Номер групи | Катіони | Груповий реагент | Аналітичний сигнал |
| I | Li+ Na+ K+ NH4+ | Відсутній | - |
| II | Ag+ Pb2+ Hg22+ | HCl | Осади нерозчинні в кислотах |
| III | Ca2+ Sr2+ Ba2+ (Pb2+) | H2SO4 | Осади нерозчинні в кислотах |
| IV | Zn2+ Al3+ Cr3+ Sn2+ Sn4+ As3+ | NaOH надлишок | Осади розчинні у надлишку |
| V | Mg2+ Mn2+ Fe2+ Fe3+ Bi3+ Sb3+ | NaOH | Осади нерозчинні в надлишку |
| VI | Ni2+ Co2+ Cu2+ Cd2+ Hg2+ | NH4OH надлишок | Осади розчинні в надлишку |
2. Поділ аніонів на аналітичні групи
Для зручності аналізу в кислотно-основному методі аналізу аніони поділяють на три аналітичні групи.
| Номер групи | Аніони | Груповий реагент | Аналітичний сигнал |
| I | SO42- SO32- S2O32- CO32- C2O42- PO43- B4O72- AsO33- AsO43- SiO32- F- | BaCl2 | осади |
| II | Cl- Br- I- CN- SCN- S2- | AgNO3 + HNO3 | осади |
| III | NO3- NO2- CH3COO- | - | - |
3. Основні визначення
Аналітична група – це група іонів яка з певним реактивом дає однотипні аналітичні реакції (однотипний аналітичний сигнал).
Реактив – хімічна речовина за допомогою якої відкривають йони.
Груповий реактив – реактив який дає однотипний аналітичний сигнал з усіма іонами даної групи.
Групова реакція – однотипна реакція для всіх іонів групи.
Індивідуальний реактив та індивідуальна реакція – реактив та реакція для виявлення окремих іонів.
Систематичний метод аналізу – метод аналізу суміші склад якої невідомий.
Дробний метод аналізу виявлення йонів за допомогою характерних реакцій коли всі іони що заважають виявленню усунуто, або в розчині присутній лише один катіон та один аніон.
4. Контрольні питання
28. Поділ катіонів та аніонів на аналітичні групи.
29. Групові реагенти та аналітичні сигнали від них.
30. Що таке аналітична група, реактив, груповий реактив, систематичний метод аналізу, дробний метод аналізу?
Лекція 5: Кількісний аналіз. Гравіметричний метод аналізу.
Мета: Засвоїти предмет та основні поняття аналітичної хімії.
План:
1. Хімічні методи кількісного аналізу
2. Гравіметричний метод аналізу
3. Контрольні питання
1. Хімічні методи кількісного аналізу
До хімічних методів кількісного аналізу належать:
- Гравіметричний (ваговий),
- Титриметричний (об'ємний),
- Газовий аналіз.
Гравіметричний аналіз ґрунтується на точному визначенні маси речовин, кількісне визначення аналізуємої речовини проводять переведенням її в малорозчинну сполуку певного хімічного складу з наступним висушуванням та зважуванням отриманого осаду. За даними зважування обчислюють масу або масову частку досліджуваної речовини.
Для точної визначення маси застосовують спеціальні аналітичні терези. Це терези, що мають точність 0,0001 – 0,002 г. Існують механічні демпферні аналітичні терези та електронні.


Титриметричний аналіз полягає в тому, що кількісний вміст речовини або суміші визначають за об’ємом реактиву точно відомої концентрації, який прореагував з певним об’ємом досліджуваного розчину. Цей процес називають титруванням.
Газовий аналіз зводиться до вимірювання об’ємів окремих компонентів газової суміші після вибіркового вбирання газів різними реагентами.
2. Гравіметричний метод аналізу
Поділяють на три групи:
- метод відгонки,
- метод осадження,
- метод виділення.
Метод відгонки використовують для визначення вмісту летких сполук. Наприклад для визначення вологості хліба, вмісту кристалізаційної води в солях.
Метод осадження. Ґрунтується на переведенні визначаємої речовини в нерозчинну речовину яку відокремлюють та визначають її масу. Найбільш вживаний метод.
Осаджувана форма – нерозчинна речовина в яку перетворюється речовина що аналізується.
Гравіметрична форма – речовина для якої визначається точна маса.
Осаджувана форма можуть як співпадати, так і не співпадати. Наприклад при визначенні іонів купруму осаджуваною формою може бути купрум гідроксид, а гравіметричною купрум оксид, який утворюється після промивання та прожарювання купрум гідроксиду.
Вимоги до осаджуваної форми:
Для того щоб результати аналізу були точними осад має бути практично нерозчинним (дуже низька розчинність).
Повинні утворюватись крупно-кристалічні осади що легко вдфільтровуються не утворюють колоїдних систем та не адсорбують інших речовин.
Кількісно перетворюватись на гравіметричну форму
Вимоги до гравіметричної форми:
Осад повинен відповідати певній хімічній формулі
Сполука повинна бути стійкою до повітря, не окилюватись та не відновлюватись не бути гігроскопічною
Для збільшення точності молярна маса повинна бути великою.
Основна перевага гравіметричного аналізу висока точність. Недолік значна затрата часу на виконання.
Після осадження осаду його промивають на фільтрі, висушують та прожарюють. Розмір фільтра визначається кількістю осаду. Лійку вибирають такого розміру, щоб краї фільтра були на 0,5 – 1 см нижче від країв лійки. Щоб маса фільтру не впливала на масу осаду як правило використовують спеціальні знезолені паперові фільтри.
Фільтри випускають різних діаметрів та різної щільності. Для зручності фільтри різної щільності обгортують стрічками різного кольору. Дрібнозернисті осади фільтрують крізь найщільніший фільтр (синя стрічка на пачці), більшість осадів крізь фільтри середньої щільності (біла стрічка на пачці), аморфні осади – крізь менш щільні (червона. Чорна стрічка на пачці).

Промивання осаду на фільтрі проводять не менше 3-4 разів доки промивні води не перестануть давати реакцію на відмивні йони.
Для прожарювання осадів використовують фарфорові або платинові тиглі. 

Для висушування та прожарювання осадів використовують сушильні шафи та муфельні печі. 

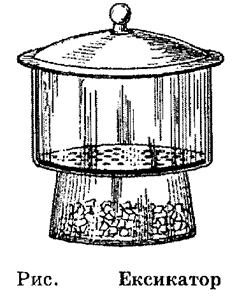
Для зберігання тиглів з осадами використовують ексикатори – товстостінні двохповерхові скляні посудини, які закриваються пришліфованою кришкою. На першому поверсі ексикатора розташовується речовина що вбирає вологу. На другому – тигель з визначаємою речовиною.
3. Контрольні питання
31. Які існують хімічні методи кількісного аналізу?
32. На які три групи поділяється гравіметричний аналіз?
33. Що таке метод відгонки?
34. Що таке метод осадження?
35. Які терези застосовують для гравіметричного аналізу?
36. Переваги та недоліки гравіметричного аналізу.
37. Осаджувана форма та вимоги до осаджуваної форми.
38. Гравіметрична форма та вимоги до гравіметричної форми.
Лекції 6-7: Титриметричний аналіз.
Мета: Засвоїти основни титриметрії.
План:
1. Основи титриметрії
2. Метод нейтралізації
3. Метод оксидиметрії
4. Інші методи титриметрії
5. Контрольні питання
1. Основи титриметрії
Суть аналізу полягає в тому, що в конічну колбу для титрування наливають за допомогою мірної піпетки певний точно виміряний об’єм розчину, що аналізується. Далі підбирають речовину (її називають робочою або титрантом), яка реагує з тою, яку визначають. Наприклад для визначення кислоти можна використати луг, для визначення окисника – відновник і т.д. Цю речовину використовують у вигляді робочого розчину – розчину з точно відомою концентрацією. Як правило концентрація робочого розчину 0,100 н., але при необхідності може бути іншою. Робочий розчин заливають у бюретку (довгу тонку трубку з поділками для точного визначення об’єму використаного титранту і пристроєм для дозування цього розчину) та поступово додають до речовини яку визначаємо. При цьому фіксують точку еквівалентності, коли прореагує вся речовина яку визначаємо, але ще не буде надлишку титранту.
Для фіксації точки еквівалентності як правило використовують індикатори. Це речовини, які при досягненні точки еквівалентності змінюють свій колір.
Тобто до досягнення точки еквівалентності у надлишку перебуває речовина яку визначаємо. Після досягнення точки еквівалентності у надлишку буде перебувати тирант.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 5596; Нарушение авторских прав?; Мы поможем в написании вашей работы!