
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вторичная
|
|
|
|
ПЕРВИЧНАЯ
СТРУКТУРЫ БЕЛКОВ
Первичная структура белка – это число и последовательность аминокислотных (АК) остатков, соединённых друг с другом пептидными связями.
Первые исследования по выяснению аминокислотных последовательностей белков были выполнены в Кембриджском университете Фредериком Сенгером, дважды нобелевским лауреатом (1958,1980) Работал с гормоном инсулина 10 лет. Было установлено, что в молекулу инсулина входит 51 аминокислотных остатков. Молекула состоит из двух полипептидных цепей, соединённых дисульфидными мостиками. В 1954 году нобелевскую премию получил Лайнус Поллинг (1953).. Он выявил, что организм человека состоит из 10 тыс. различных белков. Расшифровал геном человека.
АК последовательность белка строго определена генетическим кодом и определяет его биологические функции. Замена одной АК в молекуле белка может изменить все функции.
Вторичная структура белка представляет собой способ укладки полипептидной цепи в упорядоченную форму за счёт системы водородных связей.
Две формы вторичной структуры:
- спиральная (в пределах одной полипептидной цепи)
- слоисто-складчатая (за счет водородных связей между смежными полипептидными цепями)
Спираль (α-спираль) – сохраняет форму за счёт многочисленных водородных связей между находящимися рядом СО и NН группами.
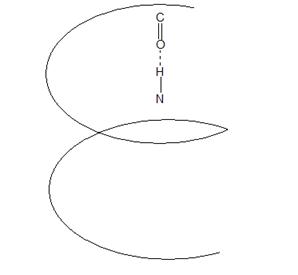
Витки спирали регулярны. В одном витке α-спирали 3, 6 АК-остатка, каждая пептидная группа образована водородной связью, с четвёртой от неё пептидной группой. α-спираль – устойчива.
Белковая молекула может иметь и другой вид – складчатый. В этом случае связываются водородной связью две антипараллельные соседние цепи (против «N» - конца одной полипептидной цепи стоит «С» - конец второй). Водородные связи перпендикулярны цепям и эта конфигурация (β-складчатый слой) прочна на разрыв, гибка (фиброин шёлка, волосы).
Белок коллаген состоит из трёх полипептидных цепей, свитых вместе, которые образуют тройную спираль. Такой белок невозможно растянуть (в сухожилиях, костных тканях). При закручивании полипептидной цепи в спираль радикалы АК- остатков направлены наружу от цепи и они могут взаимодействовать между собой, формируя третичную структуру – глобулу или фибриллу.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 431; Нарушение авторских прав?; Мы поможем в написании вашей работы!