
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типичные реакции метаболизма
|
|
|
|
и классификация ферментов.
Известно более 10 тысяч ферментов. Чтобы ориентироваться в этом множестве была введена систематика ферментов в соответствии с типами тех реакций, которые они катализируют.
Основные классы ферментов
1 класс:Оксиредуктазы
К этому классу относятся все ферменты, которые катализируют окислительно-восстановительные реакции. Под этим термином понимается реакция, которая сопровождается присоединением электрона (восстановление), отдачей электрона (окисление) или присоединением или отдачей атома водорода. Если в процессе окисления субстрат теряет водород, то фермент такой реакции носит название дегидрогеназа. Эта реакция обратима и фермент обратной реакции называется редуктаза.
|
|

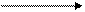 SH2 S + H2
SH2 S + H2
Если непосредственным акцептором отнимаемого от субстрата водорода выступает кислород, то фермент называется либо оксидаза
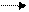 SH2 + 1/2 O2 S + H2O,
SH2 + 1/2 O2 S + H2O,
либо, если кислород внедряется в субстрат ─ монооксидаза (гидроксилаза), когда в субстрат внедряется один атом кислорода
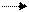 HSH + 1/2 O2 HS-OH
HSH + 1/2 O2 HS-OH
или диоксидаза, когда в субстрат внедряются два атома кислорода
 HSH + O2 HO-S-OH
HSH + O2 HO-S-OH
Переход электрона осуществляют цитохромы:
цитохромоксидаза


 a3(Cu+) – e a3(Cu2+)
a3(Cu+) – e a3(Cu2+)
 цитохромредуктаза.
цитохромредуктаза.
2 класс: Трансферазы
Эти ферменты катализируют всевозможные реакции переноса групп или атомов от одного соединения к другому.
Ферменты этого класса переносят аминогруппы (аминотрансферазы), метильные группы (метилтрансферазы), ацетильные группы (ацетилтрансферазы) и др. Например, аминотрансферазы (трансаминазы) переносят аминогруппы аминокислот на кетокислоты. Таким путем достигается эффект последовательной перестройки молекул в процессе обмена веществ.
Если переносится остаток фосфорной кислоты от нуклеозидфосфатов, то такой фермент называется киназой.
Важнейшей чертой процесса переноса является возможность переносить вместе с той или иной группой атомов и энергию, заключенную в химических связях, и тем самым создать условия для работы механизмов, осуществляющих процессы сопряжения различных биохимических реакций, когда энергия, выделяемая в одних реакциях, тут же расходуется на протекание других.
3 класс (Гидролазы)
Эти ферменты можно рассматривать как трансферазы, переносящие ту или иную группировку на молекулу воды в реакциях гидролиза углеводов, белков, жиров.
Гидролазы катализируют расщепление связей С-С, С-O, C-N, O-P и ряда других.
R1 H R1-H



 +
+
R2 H R2-OH
К числу гидролаз относится, в частности, протеазы. Смысл их химической работы заключается в том, что они разрывают пептидные связи между группами CO и NH, входящими в состав белковых молекул, что приводит к разрушению первичной структуры последних:
R1─CO─NH─R2 + H─OH → R1─CO─OH + NH2─R2
Легко видеть, что этот процесс можно рассматривать как перенос группы R1─CO─ на гидроксил ОН, а NH─ на водород Н. К группе гидролаз относятся пепсин, трипсин, химотрипсин и другие, участвующие в процессе пищеварения.
Протеазы проявляют большую активность. Так, 1 г пепсина способен разложить за два часа 25 кг сваренного яичного белка. Однако в организме эти ферменты часто находятся в неактивном состоянии. Неактивные формы называются энзимогенами («порождающими энзимы»). Активация энзимогена обусловлена отщеплением от белковой молекулы небольшого фрагмента – пептида с относительно малой молекулярной массой, удаление которого делает молекулу фермента способной вступать в промежуточные соединения с субстратом. Это один из способов, которым осуществляется регулирование деятельности ферментов.
Иногда один и тот же фермент способен катализировать гидролиз связей самой разной природы. Так, некоторые протеазы могут даже с большей эффективностью гидролизовать сложные эфиры, выступая как эстеразы («эстер» - сложный эфир). Важнейшими представителями эстераз являются липазы, ускоряющие гидролиз жиров – их ращепление на жирные кислоты и глицерин. В организме человека и животных липазы, содержатся в соке, выделяемой поджелудочной железой и печенью.
Очень большую роль играют ферменты, вызывающие гидролиз органических соединений фосфорной кислоты, называемые фосфатазами (дифосфатазами), которые регулируют присоединение фосфорной кислоты к различным углеводам или их отщепление. Процессы дыхания и брожения проходят через стадии образования и распада соединений фосфорной кислоты с глюкозой, с помощью которых организму удается использовать энергию, заключенную в углеводах (сахаре и крахмале).
4 класс: Лиазы
К ним относятся ферменты, негидролитически разрывающие связи C-C, C-O, C-N,
C-S и некоторые другие путём элиминирования (отщепления) различных молекул с одновременным образованием кратных связей.
В обратной реакции лиазы катализируют присоединие по двойной связи различных молекул (NH3, H2О).
Относящиеся к лиазам д екарбоксилазы отщепляют карбоксильную группу, альдолазы ускоряют реакции альдольного расщепления.
Лиазы катализируют также и реакции образования новых связей, но без участия АТФ и других соединений с макроэргическими связями. В этом случае их называют синтазами.
5 класс: Изомеразы
Ферменты этого класса катализируют реакции изомеризации то есть процессы структурной или пространственной перестройки молекул.
К ним относятся рацемазы, таутомеразы, циклоизомеразы
Рацемазы катализируют взаимный переход оптических изомеров из L-формы в D-форму и обратно, циклоизомеразы – из открытой формы в циклическую
6 класс: Лигазы (синтетазы)
К ним относятся ферменты, которые катализируют реакции соединения двух молекул сопряжённые с гидролизом АТФ. Играют ключевую роль в процессе биосинтеза, обеспечивая за счёт энергии освобождающейся при гидролизе АТФ, протекание таких реакций, которые сами по себе были бы невозможны. Примером могут служить аминоацил-тРНК-синтетазы.
Каждый из перечисленных шести классов ферментов также по признаку специфичности разбивают на подклассы и подподклассы, которым присваиваются порядковые номера в соответствие с Международной классификацией.
Например, гидролазы, расщепляющие эфиры карбоновых кислот, относятся к классу 3, подклассу 3.1, то есть гидролазы, действующие на сложноэфирные связи, и подподклассу 3.1.1. (гидролазы эфиров карбоновых кислот). Внутри подподкласса каждый фермент имеет свой порядковый номер. Так липаза, гидролизующая жиры (триацилглицерины), имеет номер 3.1.1.3.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 698; Нарушение авторских прав?; Мы поможем в написании вашей работы!