
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лимитирующая стадия процесса образования нерастворимых соединений
|
|
|
|
Очистка сточных вод от растворенных примесей реагентным методом. Физико-химические основы метода.
Сущность метода заключается в том, что растворенные примеси переходят в нерастворенное состояние в результате протекания обменной химический реакции:
· CaSO4+ Na2CO3=Na2SO4 + CaCO3 (14.1)
· MgSO4 +2NaOH=Mg(OH)2 + Na2SO4 (14.2)
· Na2SiF6 + CaCO3=CaSiF6 + Na2CO3 (14.3)
· HF + CaCO3 =CaF2 + CO2 + H2O (14.4)
Во всех приведенных реакциях в правой части образуются малорастворимые соединения, выпадающие в осадок (оно содержит загрязняющее вещество).
SO4, МgSO4 – эти соединения характеризуют жесткость воды.
{ Ж} общ =7ммоль/л-жесткость горячей воды после станции водоочистки
Жобщ.= Ж врем. + Жconst
Временная жесткость определяется содержанием ионов CO3-, HCO3-. Жесткость приводит к образованию осадков солей на поверхности теплообменников, что ухудшает теплопередачу.
(14.1-14.2)- освобождение от солей жесткости;
(14.3-14.4)- производство фосфорных удобрений.
Компонент Si (SiF6) используется как полуфабрикат в электрохимической промышленности, НF- сильное токсичное вещество, легколетучее, загрязняет атмосферу.
Достоинства реагентных методов:
1) простота;
2) универсальность по отношению к физико-химическому составу перерабатываемых сточных вод (селективное выделение).
Недостатки реагентных методов:
1) требуется дополнительная стадия разделения твердых и жидких фаз (сепарация);
2) высокие требования к дозированию химических реагентов.
Условия образования осадков определяется неравенством с ПР (3.2).
Пример: Растворимости (рис. 3.1) при 20°С: СCaSO4~1,8 г/л, СCaCO3~(150-200)мг/л. Почти в 10раз растворимость CaCO3 ниже растворимости СaSO4, следовательно, CaCO3 выпадет в осадок.
В результате протекания обменных реакций (14.1) образуются предварительные молекулы нерастворенных соединений, которые объединяются в агломераты постепенно с образованием критических зародышей.
Размер устойчивого критического зародыша r ~G/mxn; где:
· G – удельная поверхностная энергия образования кристалла. (G CaSO4 = 10-2 Дж/м2);
· mxn - разность химических потенциалов;
m xn = mкристалла- m растворителя.
Чем ниже G, тем труднее образуется зародыш; после образования Tкр. начинается его рост (рис. 3.2). Для описания роста кристалла используется модель с фронтальным перемещением зоны химической реакции.
Стадии гетерогенного процесса:
1. Внешняя диффузия (реакция 3.4);
2. Химическая поверхностная реакция (реакция 4.1).
Расчетная схема (рис. 14.1).
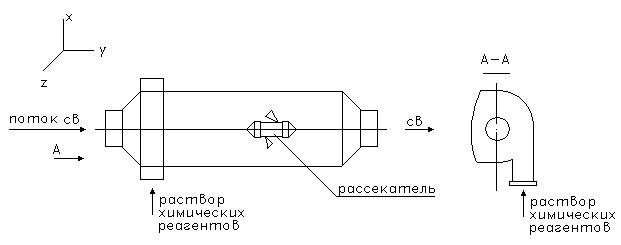
Особенностистатического реактора - отсутствие вращательных перемешивающих устройств.
Достоинства:
1. наличие рассекателя стационарного устройства понижает энергетические затраты на перемешивание (используются внутренние резервы кинетических потоков сточных вод) " поэтому статические смесители в случае осадкообразования имеют преимущество над динамическими.
Рис 14.2. Распределение поля концентраций в реакторе- смесителе.
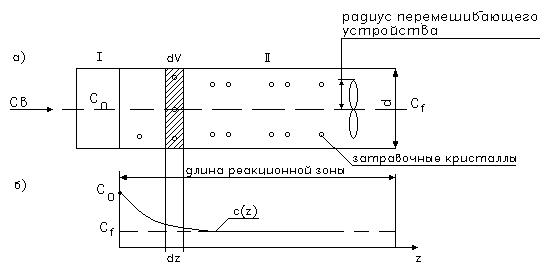
I - зона мгновенного смешивания (идеальное) сточных вод и химических реагентов.
· Время коагуляции – 2сек;
· Vсв/V хим.р-ции =103-104.
II- зона роста кристаллов и флокулообразования.
Скоростной градиент:
· dM/dz – должен плавно убывать, чтобы не разрушались флокулы;
· U – линейная скорость потока сточных вод, м/с.
В объеме реакционного пространства /V/ необходимо поддерживать определенную концентрацию затравочных кристаллов (CaCO3), т.е. необходимо создавать циркуляционные схемы с возвратом части очищенного потока в голову процесса
Основное уравнение массопередачи: dM/dt= k*CС*F
Затравочные кристаллы увеличивают удельную поверхность – f (м2/м3).
С(z) – изменение профиля по длине z.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 565; Нарушение авторских прав?; Мы поможем в написании вашей работы!