
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диаграмма состояния (плавкости) двухкомпонентных систем с одной фазой переменного состава
|
|
|
|
Подобные диаграммы состояния характерны для систем, компоненты которых неограниченно растворимы в жидком состоянии (при смешении жидких компонентов образуются гомогенные растворы во всей области концентраций), но полностью нерастворимы в твердом состоянии (не образуют твердых растворов и химических соединений). Примерами таких систем являются Cd – Bi, KCl – LiCl. На рис. 10.4 представлена принципиальная схема диаграммы плавкости описанной системы, которую часто называют диаграммой состояния с простой эвтектикой. В случае, когда компоненты не образуют химических соединений и твёрдых растворов, добавки одного из компонентов всегда понижают температуру кристаллизации другого компонента, т. е. если к жидкому компоненту А добавить растворимый в нем компонент В, то температура начала кристаллизации такого расплава будет ниже температуры плавления чистого компонента А (явление понижения температуры замерзания растворов).
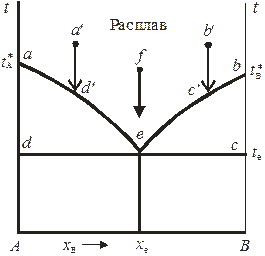
Рис. 10.4. Диаграмма плавкости двухкомпонентной системы
с простой эвтектикой.
На диаграмме 10.4 это понижение проявляется на кривых aе и bе – кривых ликвидуса, показывающих зависимости температуры начала кристаллизации смесей от состава. Выше линий ае и bе система может находиться только в расплавленном состоянии. Кривые ликвидуса для идеальных жидких растворов рассчитываются по уравнению Шредера
 .
.
Точка е, являющаяся точкой пересечения кривых ликвидуса, называется эвтектической точкой, ей соответствует самая низкая температура кристаллизации смеси (эвтектическая температура t e).
В эвтектической точке сосуществуют три фазы (чистые кристаллы А и В и расплав состава x е), поэтому в ней система инвариантна:
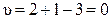 .
.
Затвердевшая смесь, соответствующая составу x е, называется эвтектической смесью или эвтектикой. При постоянном давлении температура и состав эвтектики постоянны и определяются только природой системы. При этом следут помнить, что эвтектика – не твердый раствор, а микрогетерогенная смесь кристаллов. Эвтектические смеси льда и неорганических солей называют криогидратами.
Линия, отвечающая температурам конца кристаллизации расплавов, называется линией (кривой) солидуса. На рис. 10.4 она представлена изотермой deс. Области диаграммы aеd и beс – гетерогенны. Если фигуративная точка находится в одной из этих областей, то система моновариантна и представлена двумя равновесными фазами: кристаллами одного из компонентов и жидким расплавом определенного состава. В гетерогенной области состав расплава зависит от температуры системы (уравнением связи между ними является уравнение Шредера или аналогичное ему уравнение для реальных растворов). Так, если охлаждать расплав, соответствующий точке a ' (см. рис. 10.4), то вплоть до точки d ' система будет оставаться гомогенной. В точке d ' расплав становится насыщенным относительно компонента А и в системе появляются первые кристаллы твердой фазы (кристаллы А). При дальнейшем понижении температуры система остается гетерогенной, при этом состав расплава меняется с температурой по кривой ае. В точке е расплав становится насыщенным и относительно компонента В, поэтому при эвтектической температуре система трехфазна и инварианта. При последующем понижении температуры кристаллизуется эвтектическая смесь. При охлаждении расплава состава x e от температуры, соответствующей точке f, система вплоть до точки е остается однофазной. Если же исходить из точки b', то в точке c ' в системе появляются кристаллы В, а при дальнейшем понижении температуры состав равновесного с кристаллами В расплава изменяется по кривой be. Таким образом, поле диаграммы A dex е представляет собой область существования системы в виде твердых смесей кристаллов А и эвтектики, а поле x е ec B – в виде твердых смесей кристаллов В и эвтектики.
10.3.2. Диаграммы состояния двухкомпонентных систем с неограниченной взаимной растворимостью компонентов в жидком и твёрдом состояниях
Принципиальная диаграмма состояния системы с неограниченной растворимостью компонентов в жидком и твердом состояниях представлена на рис. 10.5. Такие диаграммы состояния характерны для систем, компоненты которых могут образовывать не только жидкие, но и твердые растворы во всей области концентраций. На приведенной диаграмме верхняя кривая (кривая ликвидуса) описывает зависимость температуры кристаллизации от состава расплава, нижняя кривая (кривая солидуса) — зависимость температуры плавления от состава твердого раствора. Если исходить из точки а ' (расплав состава na) и понижать температуру, то в точке а расплав будет предельно насыщен относительно твердого раствора состава nb, соответствующего точке b.
В случае неидеальности жидкого раствора, образуемого компонентами, на диаграмме состояния могут появляются экстремумы: например, на диаграммах состояния систем Сu – Au и Сo – Cr есть минимумы температуры плавления.
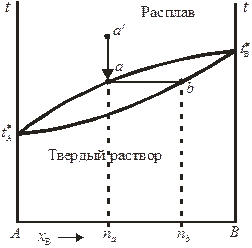
Рис. 10.5. Диаграмма плавкости бинарной системы с неограниченной
взаимной растворимостью компонентов в жидком и твердом состояниях
Твердые растворы образуются при кристаллизации жидких расплавов или при растворении газов в твердых веществах. Наиболее распространены твердые растворы замещения и внедрения, различающиеся по расположению растворенного вещества в кристаллической решетке растворителя.
При образовании твердых растворов замещения сохраняется структура кристаллической решетки растворителя, при этом атомы, молекулы или ионы в ее узлах замещаются частицами другого вещества. Существование таких растворов возможно, если оба вещества имеют не только близкие по структуре кристиллические решетки, но и близкие валентности, электроотрицательности и размеры частиц. По приближенному правилу В. Юм-Розери твердые растворы замещения образуются в тех случах, когда размеры частиц двух веществ отличаются не более чем на 15 %. Компоненты, образующие такие растворы, часто неограниченно растворимы друг в друге (т. е. образуют непрерывный ряд твердых растворов). Тип решетки и число частиц в кристаллической решетке остаются неизменными, но изменяются ее объем и плотность. Примерами систем с непрерывным рядом твердых растворов замещения являются Ag – Au, Au – Cu, KCl – KBr.
Твердые растворы внедрения получаются путем внедрения частиц растворенного вещества в междоузлия кристаллической решетки растворителя и образуются в тех случах, когда размеры частиц внедряемого вещества В меньше размеров частиц растворителя А. Обычно выполняется следующее соотношение:
 .
.
Подобные растворы возникают при растворении неметаллов (углерода, кислорода, бора, кремния и т.д.) в металлах. Поскольку внедрение новых частиц в промежутки между атомами металла сопровождается деформацией кристаллической рещетки, то область существования твердых растворов внедрения ограничена (компоненты образуют прерывный ряд твердых растворов) и, как правило, невелика. Число частиц в элементарной кристаллической ячейке и ее объем при образовании таких растворов увеличиваются.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 3206; Нарушение авторских прав?; Мы поможем в написании вашей работы!