
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методом комбинирования реакций
Расчет константы равновесия
В данном методе используются свойства функций состояния – их изменение не зависит от промежуточных стадий (реакций), а определяется только конечным и начальным состоянием системы. Следовательно, для нахождения неизвестной стандартной энергии Гиббса данной реакции можно комбинировать другие реакции с известными стандартными энергиями Гиббса так, чтобы в сумме получалась исследуемая реакция.
Разберем пример. Требуется найти константу равновесия реакции
 (I),
(I),  .
.
Экспериментальным путем определить константу равновесия данной реакции трудно, поскольку давление кислорода над оксидом никеля при невысоких температурах очень мало. С другой стороны, известны стандартные энергии Гиббса (и константы равновесия) следующих реакций:
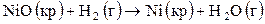 (II),
(II),  ;
;
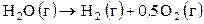 (III),
(III), 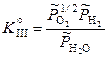 .
.
Суммируя реакции (II) и (III), получим реакцию (I). Поэтому
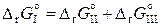 , (11.76)
, (11.76)
или
 ,
,
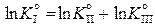 ,
,
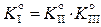 . (11.77)
. (11.77)
Термодинамические константы равновесия реакций приводятся в справочниках (напр., табл. 41, стр. 63-65).
|
Дата добавления: 2014-01-04; Просмотров: 1351; Нарушение авторских прав?; Мы поможем в написании вашей работы!