
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Первый закон термодинамики
|
|
|
|
Первый закон термодинамики является математическим выражением закона сохранения и превращения энергии в применении к термодинамическим системам.
Существует аддитивная функция состояния термодинамической системы – внутренняя энергия. Ее изменение в термодинамическом процессе зависит только от начального и конечного состояний системы, но не от пути перехода, поэтому бесконечно малое ее изменение есть полный дифференциал dU.
Приращение внутренней энергии в любом процессе равно разности теплоты, сообщенной системе, и работы, совершенной системой. В дифференциальной форме для замкнутой системы эту формулировку можно представить в следующем виде:
dU = δQ – δW. (2.1)
Теплота и работа не являются функциями состояния, их величины зависят от пути (условий протекания) процесса. Поэтому ни бесконечно малое количество теплоты δQ (элементарная теплота), ни бесконечно малое количество работы δW (элементарная работа) не являются полными дифференциалами, а функционалами (функциями от линии).
При наличии конечного изменения состояния системы (переход 1 ® 2) получаем:
 . (2.2)
. (2.2)
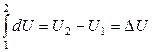 ;
; 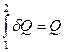 ;
; 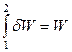 .
.
Выражение (2.2) превращается в интегральную форму записи первого закона термодинамики:
 (2.3)
(2.3)
Мерой изменения внутренней энергии является количество поступившей в систему теплоты и совершаемая ею работа. Естественно, что U, Q и W имеют одинаковую размерность.
Изолированная система не обменивается с окружающей средой ни энергией, ни массой: δQ = 0, δW = 0, dU = 0, поэтому возможна и такая формулировка первого закона термодинамики: в любой изолированной системе общее количество энергии постоянно.
Далее, если внутренняя энергия системы постоянна (dU = 0) и система не получает теплоту (δQ = 0), то она не может совершать работу (δW = 0). Устройство, совершающее работу из ничего, называется вечным двигателем первого рода. Таким образом: вечный двигатель первого рода невозможен.
И еще одна формулировка первого закона термодинамики:
теплота, подводимая к закрытой системе постоянного состава, идет на совершение работы и изменение внутренней энергии системы:
 (2.4)
(2.4)
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 872; Нарушение авторских прав?; Мы поможем в написании вашей работы!