
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вычисление изменения энтропии идеального газа
|
|
|
|
Для обратимого процесса простой системы справедливо:
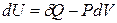 , а
, а 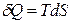 ,
,
поэтому
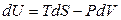 (3.31)
(3.31)
(фундаментальное уравнение термодинамики).
Объединенное уравнение первого и второго законов термодинамики (3.31) для равновесных процессов можно записать как
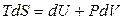 .
.
Для идеального газа фундаментальное уравнение принимает вид
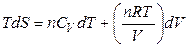 ,
,
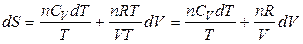 . (3.32)
. (3.32)
После интегрирования (3.32) при условии СV = const, получим
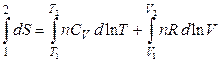 ,
,
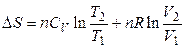 . (3.33)
. (3.33)
Так как
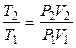 ,
,
то изменение энтропии Δ S можно представить в виде функции давления и объема:
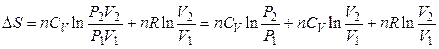 ,
,
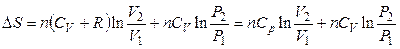 (3.34)
(3.34)
Так как
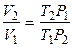 ,
,
то изменение энтропии Δ S можно представить в виде функции температуры и давления:
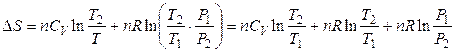 ,
,
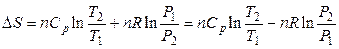 (3.35)
(3.35)
При изотермическом расширении идеального газа (Т = const) из уравнений (3.33) и (3.35) получаем:
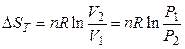 (3.36)
(3.36)
то есть при изотермическом расширении идеального газа энтропия увеличивается.
При нагревании идеального газа в изохорных или изобарных условиях энтропия также увеличивается:
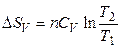 , (3.37)
, (3.37)
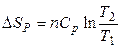 . (3.38)
. (3.38)
Помимо вычисления изменения энтропии, важно определить значение энтропии S для одного моля идеального газа. Соответствующую формулу получим, исходя из уравнения (3.35) для 1 моля газа:
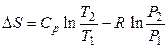 .
.
Примем, что Р 1 = Р о (стандартное давление) и Т 1 = 1 К, тогда
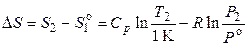 , (3.40)
, (3.40)
где 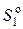 – стандартная энтропия идеального газа при T = 1 К, которую называют энтропийной постоянной идеального газа и обозначают S ′.
– стандартная энтропия идеального газа при T = 1 К, которую называют энтропийной постоянной идеального газа и обозначают S ′.
Индексы 2 в уравнении (3.40) можно отбросить, а само уравнение записать в виде
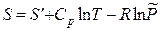 , (3.41)
, (3.41)
где 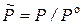 – относительное давление.
– относительное давление.
Стоящие под знаком логарифмов в уравнении (3.41) величины безразмерны. Энтропийная постоянная газа S ′ может быть вычислена по молекулярным данным методами статистической термодинамики.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1622; Нарушение авторских прав?; Мы поможем в написании вашей работы!