
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общие условия равновесия в закрытых системах
|
|
|
|
С помощью фундаментального уравнения термодинамики, записанного для различных процессов, и характеристических функций можно установить общие условия равновесия и устойчивости закрытых систем.
Рассмотрим сначала изолированную систему: U, V = const. Фундаментальное уравнение термодинамики
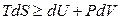
в случае изолированной системы преобразуется в
 . (4.103)
. (4.103)
Э нтропия изолированной системы при необратимых процессах увеличивается. Когда эти процессы прекратятся и наступит устойчивое равновесие, энтропия изолированной системы будет максимальна (и определяться условиями изоляции – значениями U и V).
О бщим условием устойчивого равновесия изолированной системы является максимум ее энтропии:
 ;
; 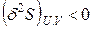 , (4.104)
, (4.104)
то есть первая вариация энтропии равна нулю, а вторая вариация меньше нуля. Оператор δ означает бесконечно малое приращение стоящей справа от него функции S при любом мыслимом в изолированной системе процессе в отличие от оператора d, который относится к какому-либо одному определенному процессу.
В закрытой системе условия равновесия будут уже другими, зависящими от способа взаимодействия системы с окружающей средой. Рассмотрим основные случаи.
1). Простая (только работа расширения) система при S, V = const. На основании фундаментального уравнения термодинамики
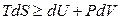 или
или  .
.
Из последнего неравенства следует, что при S, V = const
 ,
,
то есть самопроизвольные необратимые процессы будут протекать с уменьшением внутренней энергии. Так как самопроизвольные процессы заканчиваются в состоянии равновесия, то внутренняя энергия системы в этом состоянии будет минимальной. Условие равновесия для простой изохорно-изоэнтропийной системы:
 ;
;  . (4.105)
. (4.105)
2). Простая система при S, P = const. Используя функцию состояния Н – энтальпию, фундаментальное уравнение термодинамики запишетcя
 .
.
Тогда при S, P = const
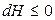 .
.
В состоянии равновесия dH = 0. Таким образом, в необратимых процессах энтальпия изобарно-изоэнтропийной системы убывает, достигая минимума в состоянии равновесия:
 ;
;  . (4.106)
. (4.106)
3). Простая изохорно-изотермическая система (при Т, V = const). Фундаментальное уравнение термодинамики для такой системы удобно записать в виде
 ,
,
откуда с учетом dT = 0 и dV = 0 получаем
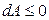 .
.
В изохорно-изотермической системе энергия Гельмгольца в необратимых процессах убывает, достигая минимума в состоянии устойчивого равновесия:
 ;
; 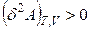 . (4.107)
. (4.107)
4). Простая изобарно-изотермическая система (при T, P = const). В данном случае фундаментальное уравнение термодинамики лучше всего записать через энергию Гиббса
 ,
,
так как dT = 0 и dP = 0, то
 .
.
В изобарно-изотермической системе энергия Гиббса в необратимых процессах убывает, достигая минимума в состоянии устойчивого равновесия:
 ;
; 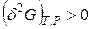 . (4.108)
. (4.108)
Таким образом, общие условия устойчивого равновесия для простых систем в различных условиях определяются экстремумами характеристических функций: максимум энтропии (изолированная система) и минимум внутренней энергии, энтальпии, энергий Гиббса и Гельмгольца.
Характеристические функции системы при заданных значениях естественных переменных могут иметь несколько экстремумов. Состояния, соответствующие наибольшему (энтропия) или наименьшему (U, H, A, G) из них, называются стабильными (абсолютно устойчивые состояния), другие – метастабильными (полуустойчивыми) состояниями. Состояние системы называется лабильным, если его любые бесконечно малые изменения приводят к возрастанию энтропии (изолированная система) или уменьшению внутренней энергии, энтальпии, энергий Гиббса и Гельмгольца (закрытые системы). Лабильные состояния – это абсолютно неустойчивые и поэтому физически нереализуемые состояния. Критерий лабильных состояний записывается таким образом:
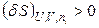 ,
, 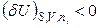 .
.
Для химиков особый интерес представляют две группы равновесий – фазовые и химические равновесия. В первой группе – фазовые равновесия – равновесие в системе устанавливается (помимо прочих условий) за счет перераспределения масс компонентов между отдельными фазами. Во второй группе – химические равновесия – достижение равновесия связано в первую очередь с протеканием химических реакций. Рассмотрим сначала фазовые равновесия.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 3597; Нарушение авторских прав?; Мы поможем в написании вашей работы!