
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Функции смешения
|
|
|
|
Термодинамические функции смесей идеальных газов.
Смешение идеальных газов – самопроизвольный (необратимый) процесс. Смесь (раствор) идеальных газов является идеальной газовой смесью и характеризуется аддитивностью парциальных давлений и парциальных объемов, а именно:
по закону Дальтона 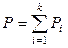 , (7.1)
, (7.1)
где P – общее давление смеси газов; Pi – парциальное давление i -го компонента (газа);
по закону Амага  , (7.2)
, (7.2)
где V – общий объем смеси газов; Vi – парциальный объем i -го компонента (газа).
Каждый компонент в смеси идеальных газов подчиняется уравнению состояния идеального газа в виде
 . (7.3)
. (7.3)
Тогда
 , (7.4)
, (7.4)
 , (7.5)
, (7.5)
где xi – мольная доля i -го компонента в смеси. Итак, парциальное давление компонента в смеси идеальных газов равно произведению его мольной доли на общее давление смеси. Аналогично можно записать, что
 . (7.6)
. (7.6)
Образование смеси идеальных газов, если исходные компоненты находились при одинаковых температуре и давлении, не сопровождается тепловыми эффектами (температура при смешении идеальных газов не меняется, общее давление смеси газов равно исходному давлению каждого газа). Поэтому внутренняя энергия U, энтальпия H, теплоемкость C и объем V смеси идеальных газов обладают аддитивными свойствами:
 ,
, 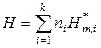 ,
,  ,
,  (7.7)
(7.7)
где  ,
,  ,
, 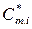 ,
,  – молярные внутренняя энергия, энтальпия, теплоемкость и объем чистого i -го компонента.
– молярные внутренняя энергия, энтальпия, теплоемкость и объем чистого i -го компонента.
В термодинамике растворов важную роль играют функции смешения, которые учитывают изменения термодинамических функций при образовании смеси (раствора) из чистых компонентов. Термодинамические функции смешения могут быть как интегральными, так и парциальными.
Интегральная функция смешения определяется разностью
 , (7.8)
, (7.8)
где Ф – интегральное свойство (функция) раствора,
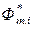 – молярная функция чистого i -го компонента.
– молярная функция чистого i -го компонента.
Например,
 , (7.9)
, (7.9)
 , (7.10)
, (7.10)
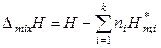 , (7.11)
, (7.11)
где D mixV, D mixU и D mixH – изменение объема, внутренней энергии и энтальпии при образовании раствора из чистых компонентов;
V, U и Н – объем, внутренняя энергия и энтальпия раствора (смеси);
 ,
, 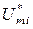 ,
,  – молярные объем, внутренняя энергия и энтальпия чистого i -го компонента.
– молярные объем, внутренняя энергия и энтальпия чистого i -го компонента.
Для 1 моля раствора числа молей в выражениях (7.8) – (7.11) заменяются на мольные доли. Например, изменение энтальпии при образовании 1 моля раствора из чистых компонентов (молярная энтальпия смешения) равно
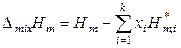 .
.
Парциальная молярная функция смешения i-го компонента определяется разностью
 , (7.12)
, (7.12)
где  – парциальная молярная величина i -го компонента. Например,
– парциальная молярная величина i -го компонента. Например,
 , (7.13)
, (7.13)
 , (7.14)
, (7.14)
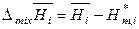 , (7.15)
, (7.15)
где 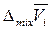 ,
,  и
и 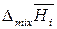 – парциальные молярные объем, внутренняя энергия и энтальпия смешения i -го компонента;
– парциальные молярные объем, внутренняя энергия и энтальпия смешения i -го компонента;
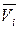 ,
,  и
и 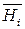 – парциальные молярные объем, внутренняя энергия и энтальпия i -го компонента в растворе;
– парциальные молярные объем, внутренняя энергия и энтальпия i -го компонента в растворе;
 ,
, 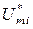 ,
,  – молярные объем, внутренняя энергия и энтальпия чистого i -го компонента.
– молярные объем, внутренняя энергия и энтальпия чистого i -го компонента.
С учетом вышеизложенного (соотношения 7.7 и определения) очевидно, что при смешении идеальных газов (при образовании раствора или смеси идельных газов)
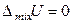 ,
,  ,
, 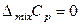 ,
, 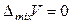 (7.16)
(7.16)
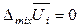 ,
, 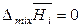 ,
, 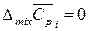 ,
, 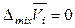 . (7.17)
. (7.17)
Согласно соотношениям (7.17) и определению (7.12) в смеси идеальных газов парциальные молярные внутренняя энергия, энтальпия, теплоемкость и объем i -го компонента равны соответствующим молярным величинам чистого i -го газа.
Энтропия также является экстенсивной (аддитивной) величиной, поэтому энтропия смеси идеальных газов равна
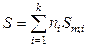 , (7.18)
, (7.18)
где Sm,i – молярная энтропия i -го идеального газа в смеси.
Однако, как было показано в главе 3 (раздел 3.5.4), молярная энтропия i -го идеального газа в смеси не равна молярной энтропии этого чистого газа
 ,
,
поскольку при смешении идеальных газов происходит изменение объема каждого из смешивающихся газов. Поэтому
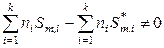 ,
,
 . (7.19)
. (7.19)
В расчете на 1 моль раствора энтропия смешения равна
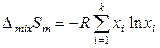 .
.
Следовательно, энергии Гиббса и Гельмгольца смешения (изменения энергий Гиббса и Гельмгольца при образовании смеси идеальных газов) также не равны нулю и с учетом выражений (7.16) и (7.19) определяются следующими соотношениями:
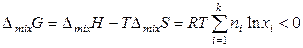 , (7.20)
, (7.20)
 . (7.21)
. (7.21)
Таким образом, термодинамические функции смеси идеальных газов в изотермических условиях определяются уравнениями:
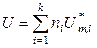 ,
, 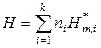 ,
,  (7.22)
(7.22)
 , (7.23)
, (7.23)
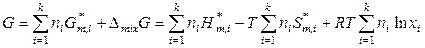 , (7.24)
, (7.24)
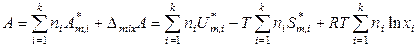 . (7.25)
. (7.25)
Учитывая вышеизложенное, понятно, что парциальные молярные энтропия, энергия Гиббса и энергия Гельмгольца смешения i -го компонента даже в смеси идеальных газов не равны нулю:
 ,
, 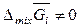 ,
,  . (7.26)
. (7.26)
Например, для системы постоянного состава (с неизменными мольными долями компонентов) будет справедливо:
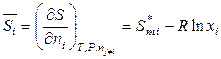 ,
, 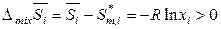 , (7.27)
, (7.27)
 ,
, 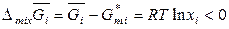 . (7.28)
. (7.28)
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 4921; Нарушение авторских прав?; Мы поможем в написании вашей работы!