
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод молекулярных орбиталей
|
|
|
|
Метод ВС широко используется химиками. В рамках этого метода большая и сложная молекула рассматривается как состоящая из отдельных двухцентровых и двухэлектронных связей. Принимается, что электроны, обусловливающие химическую связь, локализованы (расположены) между двумя атомами. К большинству молекул метод ВС может быть применен с успехом. Однако имеется ряд молекул, к которым этот метод неприменим или его выводы находятся в противоречии с опытом.
Установлено, что в ряде случаев определяющую роль в образовании химической связи играют не электронные пары, а отдельные электроны. На возможность химической связи при помощи одного электрона указывает существование иона H2+. При образовании этого иона из атома водорода и иона водорода выделяется энергия в
255 кДж (61 ккал). Таким образом, химическая связь в ионе H2+ довольно прочная.
довольно прочная.
Если попробовать описать химическую связь в молекуле кислорода по методу ВС, то придем к заключению, что, во-первых, она должна быть двойной (σ- и p-связи), во-вторых, в молекуле кислорода все электроны должны быть спарены, т.е. молекула О2 должна быть диамагнитна (у диамагнитных веществ атомы не обладают постоянным магнитным моментом и вещество выталкивается из магнитного поля). Парамагнитным веществом называется то, атомы которого или молекулы обладают магнитным моментом, и оно обладает свойством втягиваться в магнитное поле. Экспериментальные данные показывают, что по энергии связь в молекуле кислорода действительно двойная, но молекула является не диамагнитной, а парамагнитной. В ней имеется два неспаренных электрона. Метод ВС бессилен объяснить это факт.
Метод молекулярных орбиталей (МО) наиболее нагляден в его графической модели линейной комбинации атомных орбиталей (ЛКАО). Метод МО ЛКАО основан на следующих правилах.
1) При сближении атомов до расстояний химических связей из атомных орбиталей (АО) образуются молекулярные.
2) Число полученных молекулярных орбиталей равно числу исходных атомных.
3) Перекрываются атомные орбитали, близкие по энергии. В результате перекрывания двух атомных орбиталей образуются две молекулярные. Одна из них имеет меньшую энергию по сравнению с исходными атомными и называется связывающей, а вторая молекулярная орбиталь обладает большей энергией, чем исходные атомные орбитали, и называется разрыхляющей.
4) При перекрывании атомных орбиталей возможно образование и σ-связи (перекрывание по оси химической связи), и π-связи (перекрывание по обе стороны от оси химической связи).
5) Молекулярная орбиталь, не участвующая в образовании химической связи, носит название несвязывающей. Ее энергия равна энергии исходной АО.
6)На одной молекулярной орбитали (как, впрочем, и атомной) возможно нахождение не более двух электронов.
7)Электроны занимают молекулярную орбиталь с наименьшей энергией (принцип наименьшей энергии).
8)Заполнение вырожденных (с одинаковой энергией) орбиталей происходит последовательно по одному электрону на каждую из них.
Метод молекулярных орбиталей исходит из того, что каждую молекулярную орбиталь представляют в виде алгебраической суммы (линейной комбинации) атомных орбиталей. Например, в молекуле водорода в образовании МО могут участвовать только 1s атомные орбитали двух атомов водорода, которые дают две МО, представляющие собой сумму и разность атомных орбиталей 1s1 и 1s2 – МО± = C11s1 ±C21s2.
Электронная плотность этих двух состояний пропорциональна |MO±|2. Поскольку в молекуле водорода взаимодействие возможно только по оси молекулы, то каждая из MO± может быть переобозначена как σсв = 1s1 + 1s2 и σ* = 1s1 – 1s2 и названа соответственно связывающей (σсв) и разрыхляющей (σ*) молекулярными орбиталями.
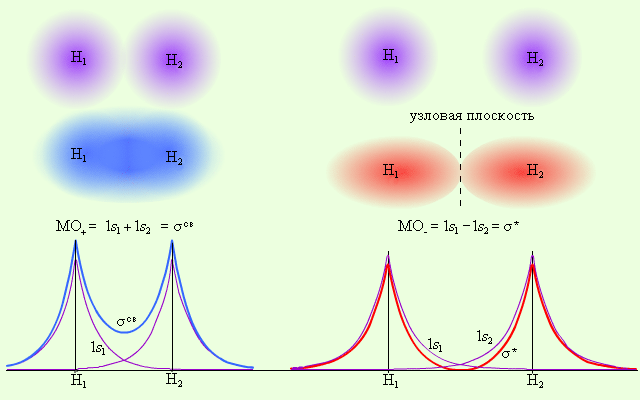 2 2
|
| Рис.10 Распределение электронной плотности в молекуле H2 |
Из рис. 10 видно, что электронная плотность посередине между ядрами для σсв значительна, а для σ* равна нулю. Отрицательно заряженное электронное облако, сконцентрированное в межъядерном пространстве, притягивает положительно заряженные ядра и соответствует связывающей молекулярной орбитали σсв. А МО с нулевой плотностью в межъядерном пространстве соответствует разрыхляющей орбитали σ*. Состояния σсв и σ* отвечают разным уровням энергии, причем молекулярная орбиталь σсв имеет более низкую энергию по сравнению с исходными АО двух невзаимодействующих атомов водорода 1s1 и 1s2.
Переход двух электронов на МО σсв способствует понижению энергии системы; этот энергетический выигрыш равен энергии связи между атомами в молекуле водорода H–H. Даже удаление одного электрона с МО (σсв)2 c образованием (σсв)1 в молекулярном ионе Н2+ оставляет эту систему более устойчивой, чем отдельно существующие атом H и ион H+.
Применим метод МО ЛКАО и разберем строение молекулы водорода. Изобразим на двух параллельных диаграммах энергетические уровни атомных орбиталей исходных атомов водорода

|
| Рис.11 Энергетическая диаграмма несвязанных атомов водорода |
Далее мысленно перекроем две атомные орбитали, образовав две молекулярные, одна из которых (связывающая) обладает меньшей энергией (расположена ниже), а вторая (разрыхляющая) – большей энергией (расположена выше).

|
| Рис.12 Диаграмма уровней энергии АО атомов H и МО молекулы H2 |
Видно(см.рис.11 и 12), что имеется выигрыш в энергии по сравнению с несвязанными атомами. Свою энергию понизили оба электрона, что соответствует единице валентности в методе валентных связей (связь образуется парой электронов).
Метод МО ЛКАО позволяет наглядно объяснить образование ионов Н2+и Н2- (см.рис.13 и 14), что вызывает трудности в методе валентных связей. На σ-связывающую молекулярную орбиталь катиона Н2+переходит один электрон атома H с выигрышем энергии. Образуется устойчивое соединение с энергией связи 255кДж/моль. Кратность связи равна ½. Молекулярный ион парамагнитен. Молекула обычного водорода содержит уже два электрона с противоположными спинами на σcв1s-орбитали: Энергия связи в Н2 больше, чем в H2+ - 435 кДж/моль. В молекуле Н2 имеется одинарная связь, молекула диамагнитна.
- 435 кДж/моль. В молекуле Н2 имеется одинарная связь, молекула диамагнитна.
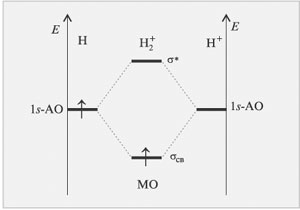
|
| Рис.13 Энергетическая диаграмма образования катиона молекулы H2 по методу МО ЛКАО |
В анионе Н2-на двух молекулярных орбиталях необходимо разместить уже три электрона.
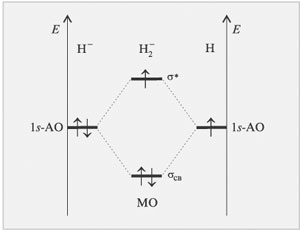
|
| Рис.14 Энергетическая диаграмма образования аниона молекулы H2 по методу МО ЛКАО |
Если два электрона, опустившись на связывающую орбиталь, дают выигрыш в энергии, то третьему электрону приходится повысить свою энергию. Однако энергия, выигранная двумя электронами, больше, чем проигранная одним. Такая частица может существовать.,
Известно, что щелочные металлы в газообразном состоянии существуют в виде двухатомных молекул. Попробуем убедиться в возможности существования двухатомной молекулы Li2, используя метод МО ЛКАО(рис.15). Исходный атом лития содержит электроны на двух энергетических уровнях – первом и втором (1 s и 2 s).
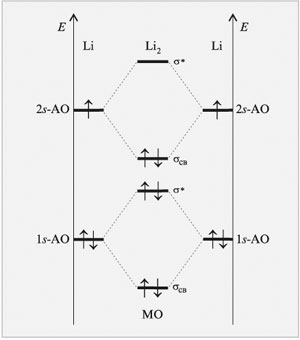
|
| Рис.15 Энергетическая диаграмма образования двухатомной молекулы Li2 по методу МО ЛКАО |
Перекрывание одинаковых 1 s -орбиталей атомов лития даст две молекулярные орбитали (связывающую и разрыхляющую), которые согласно принципу минимума энергии будут полностью заселены четырьмя электронами. Выигрыш в энергии, получаемый в результате перехода двух электронов на связывающую молекулярную орбиталь, не способен компенсировать ее потери при переходе двух других электронов на разрыхляющую молекулярную орбиталь. Вот почему вклад в образование химической связи между атомами лития вносят лишь электроны внешнего (валентного) электронного слоя.
Перекрывание валентных 2 s -орбиталей атомов лития приведет также к образованию одной σ-связывающей и одной разрыхляющей молекулярных орбиталей. Два внешних электрона займут связывающую орбиталь, обеспечивая общий выигрыш в энергии (кратность связи равна 1).
Используя метод МО ЛКАО, рассмотрим возможность образования молекулы He2.
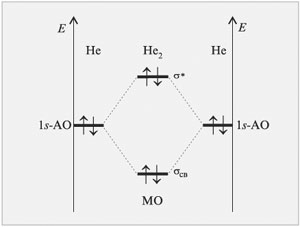
|
| Рис.16 Энергетическая диаграмма, иллюстрирующая с помощью метода МО ЛКАО невозможность образования химической связи между атомами He |
В этом случае два электрона займут связывающую молекулярную орбиталь, а два других – разрыхляющую. Выигрыша в энергии такое заселение двух орбиталей электронами не принесет. Следовательно, молекулы He2 не существует.
Заполнение молекулярных орбиталей происходит при соблюдении принципа Паули и правила Хунда по мере увеличения их энергии в такой последовательности:
σ1s < σ*1s < σ2s < σ*2s < σ2pz < π2px = π2py < π*2px =π*2py < σ*2pz
Значения энергии σ2p и π2p близки и для некоторых молекул(В2,С2,N2) соотношение обратное приведённому: сначала π2p потом σ2p
Таблица 2 Энергия и порядок связи в молекулах элементов 1 периода
| Молекулы и молекулярные ионы | Электронная конфигурация | Энергия связи кДж/моль | Порядок связи |
| Н2+ | (σs)1 | 0,5 | |
| Н2 | (σs)2(σs*)1 | ||
| Н2- | (σs)2(σs*)1 | - | 0,5 |
| НеН | (σs)2(σs*)1 | - | 0,5 |
| Не2+ | (σs)2(σs*)1 | 0,5 | |
| Не2 | (σs)2(σs*)2 | - |
Согласно методу МО п орядок связи в молекуле определяется разностью между числом связывающих и разрыхляющих орбиталей, деленный на два. Порядок связи может быть равен нулю (молекула не существует), целому или дробному положительному числу. При нулевой кратности связи,как в случае Не2,молекула не образуется.
На рисунке 17 изображена энергетическая схема образования молекулярных орбиталей из атомных для двухатомных гомоядерных (одного и того же элемента) молекул элементов второго периода. Число связывающих и разрыхляющих электронов зависит от их числа в атомах исходных элементов.
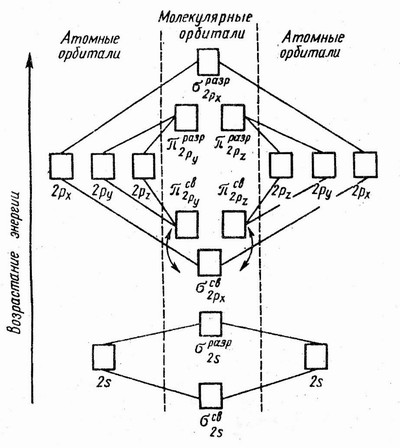
Рис.17 Энергетическая диаграмма образования двухатомных молекул
элементов 2 периода
Следует отметить, что при образовании молекул В2, С2 и N2 энергия связывающей s2 px -орбитали больше энергии связывающих p2 py - и p2 pz -орбиталей, тогда как в молекулах О2 и F2, наоборот, энергия связывающих p2 py - и p2 pz -орбиталей больше энергии связывающей s2 px -орбитали. Это нужно учитывать при изображении энергетических схем соответствующих молекул.
Подобно электронным формулам, показывающим распределение электронов в атоме по атомным орбиталям, в методе МО составляются формулы молекул, отражающие их электронную конфигурацию. По аналогии с атомными s-, p-, d-, f- орбиталями молекулярные орбитали обозначаются греческими буквами s, p, d,,j.
Образование молекул из атомов элементов II периода может быть записано следующим образом (К – внутренние электронные слои):
Li 2 [KK(σs)2]
Be2 [KK(σs)2(σs*)2] молекула не обнаружена, как и молекула Не2
B2 [KK(σs)2(σs*)2 (πx)1(πy)1] молекула парамагнитна
C2 [KK(σs)2(σs*)2(πx)2(πy)2]
N2 [KK(σs)2(σs*)2(πx)2(πy)2(σz)2 ]
O2 [KK(σs)2(σs*)2(σz)2(πx)2(πy)2(πx)1(πy)1 ] молекула парамагнитна
F2 [KK(σs)2(σs*)2(σz)2(πx)2(πy)2(πx)2(πy)2 ]
Ne2 [KK(σs)2(σs*)2(σz)2 (πx)2(πy)2(πx)2(πy)2(σz*)2 ] молекула не обнаружена
Методом МО ЛКАО легко продемонстрировать парамагнитные свойства молекулы кислорода. С тем чтобы не загромождать рисунок, не будем рассматривать перекрывание 1 s -орбиталей атомов кислорода первого (внутреннего) электронного слоя. Учтем, что p -орбитали второго (внешнего) электронного слоя могут перекрываться двумя способами. Одна из них перекроется с аналогичной с образованием σ-связи.

|
| Рис.18 Перекрывание p-АО, направленных вдоль оси x σ-связи |
Две других p -АО перекроются по обе стороны от оси x с образованием двух π-связей.

|
| Рис.19 Перекрывание p-АО, направленных вдоль оси y (z), с образованием π-связи |
Энергии молекулярных орбиталей могут быть определены по данным спектров поглощения веществ в ультрафиолетовой области. Так, среди молекулярных орбиталей молекулы кислорода, образовавшихся в результате перекрывания p -АО, две π-связывающие вырожденные (с одинаковой энергией) орбитали обладают меньшей энергией, чем σ-связывающая, впрочем, как и π*-разрыхляющие орбитали обладают меньшей энергией в сравнении с σ*-разрыхляющей орбиталью.

|
| Рис.20 Энергетическая диаграмма, иллюстрирующая с помощью метода МО ЛКАО парамагнитные свойства молекулы O2 |
В молекуле O2 два электрона с параллельными спинами оказались на двух вырожденных (с одинаковой энергией) π*-разрыхляющих молекулярных орбиталях. Именно наличием неспаренных электронов и обусловлены парамагнитные свойства молекулы кислорода, которые станут заметными, если охладить кислород до жидкого состояния.
Так, электронная конфигурация молекул О2 описывается следующим образом:О2[КК(σs)2(σs*)2(σz)2(πx)2(πy)2(πx*)1(πy*)1]
Буквами КК показано, что четыре 1 s -электрона (два связывающих и два разрыхляющих) практически не оказывают влияния на химическую связь.
Среди двухатомных молекул одной из наиболее прочных является молекула CO. Метод МО ЛКАО легко позволяет объяснить этот факт.

|
| Рис.21 Энергетическая диаграмма, иллюстрирующая с помощью метода МО ЛКАО особую прочность химической связи в молекуле CO |
Энергии АО атома кислорода лежат ниже энергий соответствующих орбиталей углерода (1080 кДж/моль), они расположены ближе к ядру. Результатом перекрывания p -орбиталей атомов O и C является образование двух вырожденных π-связывающих и одной σ-связывающей орбитали. Эти молекулярные орбитали займут шесть электронов. Следовательно, кратность связи равна трем. Электронная конфигурация такая же, как и у N2:
[КК(σs)2(σs*)2(σz)2(πx)2(πy)2 (σz)2]. Прочность связи в молекулах СО(1021кДж/моль) и N2(941кДж/моль) близки.
При удалении одного электрона,который уходит со связывающей орбиты (образование иона CO+)б прочность связи уменьшается до 803 кДж/моль. Кратность связи становится равной 2,5.
Метод МО ЛКАО можно использовать не только для двухатомных молекул, но и для многоатомных. Разберем в качестве примера в рамках данного метода строение молекулы аммиака.

|
| Рис.22 Энергетическая диаграмма образования молекулы NH3 по методу МО ЛКАО |
Поскольку три атома водорода имеют только три 1 s -орбитали, то суммарное число образованных молекулярных орбиталей будет равно шести (три связывающих и три разрыхляющих). Два электрона атома азота окажутся на несвязывающей молекулярной орбитали (неподеленная электронная пара).
Наилучшим способом квантовомеханической трактовки химической связи в настоящее время считается метод молекулярных орбиталей (МО). Однако он гораздо сложнее метода ВС и не столь нагляден, как последний.
Существование связывающих и разрыхляющих МО подтверждается физическими свойствами молекул. Метод МО позволяет предвидеть, что если при образовании молекулы из атомов электроны в молекуле попадают на связывающие орбитали, то потенциалы ионизации молекул должны быть больше, чем потенциалы ионизации атомов, а если электроны попадают на разрыхляющие орбитали, то наоборот.Так, потенциалы ионизации молекул водорода и азота (связывающие орбитали) – 1485 и 1500 кДж/моль соответственно – больше, чем потенциалы ионизации атомов водорода и азота – 1310 и 1390 кДж/моль, а потенциалы ионизации молекул кислорода и фтора (разрыхляющие орбитали) – 1170 и 1523 кДж/моль – меньше, чем у соответствующих атомов – 1310 и 1670 кДж/моль. При ионизации молекул прочность связи уменьшается, если электрон удаляется со связывающей орбитали (H2 и N2), и увеличивается, если электрон удаляется с разрыхляющей орбитали(О2 и F2).
Рассмотрим образование МО в молекуле фтористого водорода HF. Поскольку потенциал ионизации фтора (17,4 эВ или 1670 кДж/моль) больше, чем у водорода (13,6 эВ или 1310 кДж/моль), то 2р-орбитали фтора имеют меньшую энергию, чем 1s-орбиталь водорода. Вследствие большого различия энергий 1s-орбиталь атома водорода и 2s-орбиталь атома фтора не взаимодействуют. Таким образом, 2s-орбиталь фтора становится без изменения энергии МО в HF. Такие орбитали называются несвязывающими. 2ру- и 2рz –орбитали фтора также не могут взаимодействовать с 1s-орбиталью водорода вследствие различия симметрии относительно оси связи. Они тоже становятся несвязывающими МО. Связывающая и разрыхляющая МО образуются из 1s-орбитали водорода и 2рх-орбитали фтора. Атомы водорода и фтора связаны двухэлектронной связью с энергией 560 кДж/моль.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 10379; Нарушение авторских прав?; Мы поможем в написании вашей работы!