
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основы молекулярно- кинетической теории
|
|
|
|
Молекулярная физика и термодинамика.
Молекулярно-кинетическая теория — это раздел физики, изучающий свойства различных состояний вещества, основывающийся на представлениях о существовании молекул и атомов как мельчайших частиц вещества.
В основе МКТ лежат три основных положения:
1. Все вещества состоят из мельчайших частиц: молекул, атомов.
2. Эти частицы находятся в непрерывном хаотическом движении
3. Между частицами существуют силы притяжения и отталкивания, характер которых зависит от расстояния между ними.
Массы молекул очень малы. Например, масса молекулы воды: 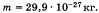
Поэтому количество молекул даже в малом объеме вещества значительно.
Единицей количества вещества является моль. Моль — это количество вещества, содержащее столько же атомов или молекул любого вещества, сколько содержится атомов в 12 г углерода C612.
Молекулярной массой М вещества называется отношение массы молекулы этого вещества к 1/12 массы атома углерода C612
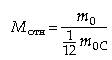
Число частиц, содержащееся в моле или вещества называется числом Авогадро. NA= 6,022×1023 моль-1
Количество вещества (ν) равно отношению числа атомов (молекул) этого вещества к числу Авогадро
ν =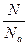
Молярная масса M равна массе вещества, взятого в количестве одного моля. [M] = кг/моль. Молярная масса равна M = m0NA,где m0 — масса отдельного атома (молекулы).
Масса m любого количества вещества, содержащего N атомов (молекул), равна m = m0N = ν M, откуда количество вещества (в молях) равно ν = m/M.
Идеальным принято считать газ, если: а) между молекулами отсутствуют силы притяжения, т. е. молекулы ведут себя как абсолютно упругие тела;
б) газ очень разряжен, т.е. расстояние между молекулами намного больше размеров самих молекул;
Основное уравнение МКТ идеального газа:
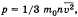 , где р — давление идеального газа, m
, где р — давление идеального газа, m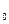 — масса молекулы,
— масса молекулы, 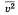 среднее значение квадрата скорости молекул газа, n- концентрация молекул/
среднее значение квадрата скорости молекул газа, n- концентрация молекул/
Cреднее значение кинетической энергии поступательного движения молекул идеального газа 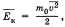 получим основное уравнение МКТ
получим основное уравнение МКТ
идеального газа в виде: 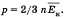
термодинамического равновесия (состояния, при котором не происходит изменения микроскопических параметров).
Температура - термодинамическая величина, характеризует тепловое состояние системы, характеризует интенсивность хаотического движения молекул и измеряется их средней кинетической энергией. Ек = 3/2 kT, где k = 1,38 • 10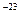 Дж/К и называется постоянной Больцмана, Т – температура по абсолютной шкале Кельвина. 1 К = 1 °С.
Дж/К и называется постоянной Больцмана, Т – температура по абсолютной шкале Кельвина. 1 К = 1 °С.
По шкале Кельвина за ноль принят абсолютный ноль температур, т. е. температура, при которой давление идеального газа при постоянном объеме равно нулю. Теоретически при абсолютном нуле скорость поступательного движения молекул равна нулю, т. е. прекращается тепловое движение молекул.
Абсолютный нуль температуры по шкале Цельсия равен -273 °С. Связь между абсолютной шкалой температур (Т)и шкалой Цельсия (t): существует связь Т = t °C + 273
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1041; Нарушение авторских прав?; Мы поможем в написании вашей работы!