
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основы биохимии 11 страница
|
|
|
|
Конкурентное ингибирование может быть вызвано веществами, похожими по своей структуре на субстрат. Эти вещества, конкурируя с субстратом, соединяются с активным центром фермента, но не подвергаются ферментативному превращению и новые продукты из них не образуются. В связи с тем, что часть фермента при конкурентном ингибировании расходуется на образование комплеса фермент-ингибитор, скорость ферментативной реакции снижается. Конкурентное ингибирование обратимо, так как при увеличении концентрации субстрата скорость реакции возрастает.
Неконкурентное ингибирование вызывают вещества, не имеющие структурного сходства с субстратом. Причем эти вещества обратимо присоединяются к ферменту не в активном центре, где обычно связывается субстрат, а совсем в другом месте и, следовательно, конкуренция между субстратом и ингибитором отсутствует. Связываясь с ферментом, неконкурентные ингибиторы вызывают изменение пространственной структуры активного центра, и, хотя присоединение субстрата к такому активному центру происходит, тем не менее катализ становится невозможным. Неконкурентные ингибиторы связываются обратимо как со свободным ферментом, так и с фермент-субстратным комплексом, образуя неактивные фермент-ингибитор (ЕJ) и (или) фермент-субстрат-ингибитор (ESJ).
Наряду с инигибиторами существует целый ряд активаторов ферментов. А к т и в а т о р а м и называют вещества, увеличивающие каталитическую активность ферментов. Среди активаторов встречаются самые разнообразные вещества. Особенно часто роль активаторов ферментов выполняют ионы металлов: калия, кальция, магния, цинка, меди, железа, марганца, кобальта, а из анионов - хлора. Для проявления максимальной активности ферментов требуется определнная концентрация ионов-активаторов в среде.
Усиление активности ферментов под действием ионов металлов объясняется тем, что в одних случаях ионы металлов выполняют роль кофактора, в других - облегчают образование фермент-субстратного комплекса, в третьих - способствуют прсоединеию кофермента к апоферменту, в четвертых обеспечивают становление четвертичной структуры фермента или же действуют иными путями.
Мощное действие на ферменты оказывают вещества, присоединяющиеся к ним в особых участках, удаленных от активного центра, называемых а л л о с т е р и ч е с к и м ц е н т р о м. Эти вещества влияют на активность фермента, вызывая обратимое изменение в структуре его активного центра. Называют такие вещества а л л о с т е р и ч е с к и м и э ф ф е к т о р а м и. Если эти эффекторы увеличивают сродство фермента к субстрату, то их называют а л л о с т е р и ч е с к и м и активаторами, если уменьшают - а л л о с т е р и ч е с к и м и ингибиторами. Ферменты, активность которых регулируется аллостерическими активаторами или ингибиторами называют а л л о с т е р и ч е с к и м и. Большинство аллостерических ферментов представляют собой белки-олигомеры.
Аллостерические ферменты имеют важное значение в регуляции ферментативных процессов в клетке. Это связано с тем, что эффекторами могут быть различные промежуточные продукты обмена веществ, называемые м е т а б о л и т а м и. В частности, установлено, что конечный, а иногда и промежуточный продукт многостадийного процесса распада или биосинтеза может служить аллостерическим ингибитором одной из первых его реакций.
4.7 Номенклатура и классификаия ферментов
В настоящее время известно более 2400 ферментов. Каждый фермент, как правило, имеет две номенклатуры; одна из них рабочая (тривиальная), а другая - систематическая.
Рабочее наименоваие фермента составляют путем прибавления к корню слова латинского, греческого или химического названия субстрата, на который действует фермент, или к названию процесса, катализируемого данным ферментоа окончания “-аза”. Вещество, имеющее это окончание, принимают за фермент. Ферменты, действующие на крахмал (amylum), сахарозу, мочевину (urea), пептиды получили соответственно названия: амилаза, сахараза, уреаза,пептидаза; ферменты, катализирующие процессы гидролиза называют гидролазами, процессы окисления - оксидазами, перенос групп - трнсферазами и т.д. Для некоторых ферментов сохранены названия, неподчиняющиеся этому правилу: пепсин, трипсин, химотрипсин папин и др.
В названии ряда ферментов указывают как характер субстрата, так и тип катализируемой реакции. Фермент, катализирующий отнятие водорода от спирта, называют алкогольдегирогеназа.
Рабочим названием ферментов пользуются в повседневной практике.
В 1961 г. Международная комиссия по ферментам, созданная в 1956 г., предложила новую схему номенклатуры и классификации ферментов, которая была принята Международным биохимическим союзом. Согласно этой схемы каждый фермент имеет как рекомендуемое (рабочее) название, так и систематическое название, которое составляется в определенном порядке и подчеркивает тип катализируемой реакции (см. классы ферментов).
В принятой классификации все ферменты на основании катализируемых реакций разделены на шесть классов, расположенных в следующем порядке: 1) оксидоредуктазы, 2) трансферазы, 3) гидролазы, 4) лиазы, 5) изомеразы, 6) лигазы (синтетазы). Каждый класс подразделяется на подклассы, а каждый подкласс - на подподклассы. Индивидуальный фермент имеет кодовое число (шифр) со стоящими перед ним буквами КФ (англ. ЕС). Шифр каждого фермента содержит четыре числа, разделенных точками. Первое число указывает к какому из шести классов принадлежит данный фермент. Второе число обозначает подкласс. Третье число обозначает подподкласс, а четвертое - порядковый номер фермента в данном подподклассе. Например, фермент КФ.1.1.1.1 имеет рекомендуемое (рабочее) название алкогольдегидрогеназа, систематическое название алкоголь:НАД оксидоредуктаза. Этот фермент относится к классу оксидоредуктаз (1), действует на СН-ОН группу доноров (1.1), акцептором водорода служит НАД (1.1.1); четвертая цифра шифра - порядковый номер фермента в пределах подподкласса.
Систематическое название и шифр фермента используют в научных публикациях при первом упоминании о нем; при дальнейшем изложении материала пользуются рекомендуемым (рабочим) названием.
4.8 Классы ферментов и их отдельные представители
4.8.1.Оксидоредуктазы(1)
К классу оксидоредуктаз принадлежат все ферменты, катализирующие окислительно-восстановительные реакции. Субстрат, подвергающийся окислению рассматривается как донор водорода. Систематическое назва-ние составляется по типу “донор:акцептор оксидоредуктаза”. Термины “донор” и “акцептор” введены потому, что происходит реакция переноса двух восстановительных эквивалентов в той или иной форме (атомов водо-рода, электронов, гидрид-ионов и т.д.) от одного субстрата (окисляемого) к другому (восстанавливаемому).
В зависимости от природы окисляемых групп в молекуле донора оксидоредуктазы разделили на 19 подклассов. Деление на подподклассы произведено в зависимости от природы акцепторов, которыми могут быть кофермент (НАД или НАДФ), цитохром, молекулярный кислород и т.д.
Рекомендуемое название включает следующие термины. Оксидоредуктазы всех подподклассов, для которых акцептором водорода служит любое соединение, но не кислород, называют дегидрогеназами, а в случаях, когда донор водорода точно не установлен, используют термин редуктаза. Если акцептором служит кислород, то ферменты, катализирующие перенос водорода на него, называют оксидазами. Реакции прямого включения кислорода в молекулу органического субстрата катализируют оксигеназы; при этом происходит включение либо двух атомов кислорода (диоксигеназы), либо одного атома кислорода (монооксигеназы). Термин пероксидаза относится к ферментам, использующим в качестве окислителя пероксид водорода.
Многие дегидрогеназы в качестве акцептора водорода используют коферменты НАД (никотинамидадениндинуклеотид) и НАДФ (никотинамидадениндинуклеотидфосфат), содержащие в своих молекулах производ-ное пиридина - никотинамид. В связи с чем эти ферменты получили название пиридиновых (пиридинзависимых) дегидрогеназ, или пиридин-протеинов. Приводим структурную формулу окисленной формы НАД и НАДФ (обозн. НАД+ и НАДФ+).

 O Никотинамид Аденин NH2
O Никотинамид Аденин NH2





 ú ç ê
ú ç ê










 C-NH2 N N
C-NH2 N N


 O O
O O




 + ÷ ç ÷ ç N
+ ÷ ç ÷ ç N







 N O H2C¾O ¾ P ¾ O ¾ P¾ O ¾ CH2 O N
N O H2C¾O ¾ P ¾ O ¾ P¾ O ¾ CH2 O N
½ ½



 H H H H ОН ОН H H H H
H H H H ОН ОН H H H H
 |  |
OH OH OH OR
R = Н (в НАД+) и РО(ОН2) (в НАДФ+).
Пиридиновые дегидрогеназы отнимают от своих субстратов по два водородных атома. Один из них в виде гидрид-иона (Н-) присоединяется непосредственно к пиридиновому кольцу НАД+ или НАДФ+, а второй в виде Н+-иона переходит в среду:

 O H H O
O H H O




 СН ú ç C ú ê
СН ú ç C ú ê









 Н C-NH2 C -NH2
Н C-NH2 C -NH2

 Субстрат + Субстрат + + H+
Субстрат + Субстрат + + H+




 Н + (окисленный)
Н + (окисленный)
N N
½ ½
R R
(Восстановленная форма нуклеотидных коферментов обозначается НАД·Н + Н+ (сокр. НАД·Н) и НАДФ·Н+Н+ (сокр. НАДФ·Н).
В общем виде реакции, катализируемые пиридиновыми дегидро-геназами, можно записать следующим образом:
 Н НАД+ НАД·Н+Н+
Н НАД+ НАД·Н+Н+
 Субстрат + Субстрат +
Субстрат + Субстрат +
 Н (НАДФ+) (окисленный) (НАДФ·Н+Н+)
Н (НАДФ+) (окисленный) (НАДФ·Н+Н+)
При каталитическом участии фермента трансгидрогеназы НАД·Н и НАДФ+, равно как НАДФ·Н и НАД+, могут обмениваться атомами водорода:

 НАДФ·Н + НАД+ НАДФ+ + НАД·Н
НАДФ·Н + НАД+ НАДФ+ + НАД·Н
Установлено, что большая часть пиридиновых дегидрогеназ функционирует только с коферментом НАД, меньшая - только с НАДФ и сравнительно небольшая группа - как с НАД, так и с НАДФ.
Считается, что восстановительные эквиваленты от НАД·Н расходуются для запаса энергии в виде АТФ, а от НАДФ·Н для восстановительных этапов процессов биосинтеза.
Пиридиновые дегидрогеназы называют анаэробными, т.к. они передают отнятый от субстрата водород любому соединению, но не кислороду.
Наряду с пиридиновыми дегидрогеназами в окислительно-восстановительных реакциях участвуют флавиновые (флавинзависимые) дегидрогеназы, или флавопротеины. Такое название эти ферменты получили в связи с тем, что в качестве простетической группы (прочно связанного с белковой частью кофермента) содержат флавинмононуклеотид (ФМН) или флавинадениндинуклеотид (ФАД):
O О
֕ ֕ NH2

 СН2 ¾(СНОН)¾СН2 ¾ О¾Р ¾ О¾ Р¾ОН ê
СН2 ¾(СНОН)¾СН2 ¾ О¾Р ¾ О¾ Р¾ОН ê








 ô ï ½ N N
ô ï ½ N N








 N N OH О
N N OH О









 H3C- =O ½ N
H3C- =O ½ N










 NH CH2 O N
NH CH2 O N
 H3C- N
H3C- N



 ֕ H H H H
֕ H H H H
 O
O
OH OН 







 Рибофлавин
Рибофлавин








 ФМН (окисленный) АМФ
ФМН (окисленный) АМФ

 ФАД (окисленный)
ФАД (окисленный)
Большинство флавиновых дегидрогеназ содержит в своем составе ФАД.
Катализ окислительно-восстановительных реакций флавиновыми дегидрогеназами обусловлен последовательным окислением и восстановлением изоаллоксазинового кольца рибофлавина:
R R H
½ ½ ½












 N N N N
N N N N


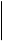




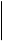
 H3C
H3C 
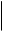
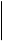
 = O + 2H H3C
= O + 2H H3C 
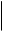
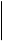
 =O
=O
 |  | ||||||||
 | |||||||||
 |  | ||||||||









 H3C
H3C 
 NH H3C NH
NH H3C NH

 N C N C
N C N C
 ÷ ê ½ ÷ ê
÷ ê ½ ÷ ê
O H O
Окисленная форма Восстановленная форма
К а т а л а з а (КФ 1.11.1.6; пероксид водорода:пероксид водорода оксидоредуктаза) катализирует следующую реакцию:
 Н2О2 + Н2О2 2Н2О + О2
Н2О2 + Н2О2 2Н2О + О2
Каталаза - двухкомпонентный фермент, простетической группой которого является гематин, представляющий протопорфирин, содержащий атом трехвалентного железа (см. формулу на стр. 134).
Этот фермент широко распространен в природе и найден у животных, растений, аэробных бактерий. Роль каталазы в организме связывают с расщеплением образующегося в процессе окисления ядовитого для клеток пероксида водорода.
Каталаза содержится и в молоке. В молоко она переходит из клеток молочной железы, а также вырабатывается содержащимися в молоке бактериями и лейкоцитами.
аталазное число молока от здоровых коров составляет 0,7 - 2,5. Молоко коров с больным выменем и молозиво имеют каталазное число достигающее 15 и выше.
Следующий фермент этого подкласса п е р о к с и д а з а (КФ 1.11.1.7; донор:пероксид водорода оксидоредуктаза). Пероксидаза содержится в тканях животных и растений, молоке, лейкоцитах, некоторых бактериях; катализирует окисление фенолов, аминов, некоторых гетероциклических соединений (например, индола) по схеме:
 донор + Н2О2 окисленный донор + 2 Н2О.
донор + Н2О2 окисленный донор + 2 Н2О.
Пероксидаза - двухкомпонентный фермент, ее простетическая группа представлена гематином. Гематин каталазы и пероксидазы имеет одинаковое строение. Следовательно, различия в каталитической функции этих ферментов определяются исключительно белковой частью.
Пероксидаза играет важную роль в дыхании растений. В молочной промышленности реакцию на пероксидазу используют для контроля эффективности пастеризации молока (пероксидаза молока инактивируется при температуре около 80ОС). Реакцию на пероксидазу применяют для оценки свежести мяса птицы (кроме водоплавающей). Свежее мясо дает положительную реакцию; мясо подозрительной свежести - отрицательную.
Ц и т о х р о м н а я с и с т е м а. Эта система состоит из цитохромов и фермента цитохромоксидазы. Цитохромы принадлежат к сложным белкам; их железопорфириновая простетическая группа, называемая гем, по своему строению очень близка к простетической группе гемоглобина (см. хромопротеины).
Все известные цитохромы в зависимости от природы гема разделены на четыре группы: а, в, с и d. Железопорфириновые структуры каждого из этих цитохромов различаются боковыми цепями. Кроме этого цитохромы отличаются друг от друга белковыми компонентами и по способу присоединения простетической группы к белку. У цитохромов с хорошо установленной структурой при букве ставят числовой индекс, указывающий на принадлежность цитохрома к определенной подгруппе. Например, в митохондриях высших животных и растений идентифицировано пять различных цитохромов: а, а3, в, с, с1.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 569; Нарушение авторских прав?; Мы поможем в написании вашей работы!