
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение степени окисления элементов в соединениях
|
|
|
|
Классификация химических реакций
Окислительно-восстановительные процессы
Окислительно-восстановительные реакции играют важную роль в природе и технике. В качестве примеров окислительно-восстановительных процессов, протекающих в природных биологических системах, можно привести реакцию фотосинтеза у растений и процессы дыхания у животных и человека, реакции обмена веществ в живых организмах. Процессы сжигания топлива, протекающие в топках котлов тепловых электростанции и в двигателях внутреннего сгорания, являются примерами технически важных окислительно-восстановительных реакций.
Окислительно-восстановительные реакции можно наблюдать в процессах коррозии металлов и при электролизе. Они лежат в основе металлургических процессов и кругооборота элементов в природе. С их помощью получают многие ценные продукты (аммиак, щелочи, азотную, соляную, серную кислоты и т. д.). Благодаря окислительно-восстановительным реакциям происходит превращение химической энергии в электрическую в гальванических элементах и аккумуляторах. Они же лежат в основе мероприятий по охране природы.
Исследование космоса стало возможным вследствие использования реакций между такими сильными восстановителями, как водород, гидразин и керосин, и окислителями – кислородом и оксидами азота.
Все многообразие химических процессов можно разделить на два типа
1. Реакции, протекающие без изменения степени окисления элементов, входящих в состав реагирующих веществ.
Например:
а) Ca(OH)2 + 2CO2 = Ca(HCO3)2 реакция соединения;
б) NaOH + HCl = NaСl+H2O реакция обмена;
в) CaCO3 = CaO + CO2 реакция разложения.
Сохранение степени окисления показывает, что электронные оболочки атомов в реакциях данного типа претерпевают незначительные изменения.
Ни один из атомов или ионов не теряет и не приобретает электронов. Такие реакции называются электростатическими.
2. Реакции, сопровождающиеся изменением степени окисления элементов, входящих в состав реагирующих веществ:
а) все реакции замещения:
Zn0+H21+SO4 = Zn2+SO4+H20 ;
б) реакции соединения, в которых участвует хотя бы одно простое вещество:
Fe0+S0 = Fe2+S2-,
2 FeCl2+Cl2 = 2 FeCl3;
в) реакции разложения, когда требуется хотя бы одно простое вещество:
2Ag+2O = 4Ag+O2
и многие другие реакции, например,
Mn4+O2+4HСl-1 = Mn2+Cl2+Cl20+2H2O.
Изменение степени окисления связано с потерей или приобретением электронов. Поэтому реакции данного типа называются электронно-динамическими.
Современная классификация – по донорно-акцепторному механизму:
а) электрон-донорно-акцепторные – это окислительно-восстанови-тельные реакции;
б) протон-донорно-акцепторные – кислотно-основное взаимодействие по Бренстеду-Лоури;
в) партикуло-донорно-акцепторные – реакции комлексообразования
.
Все химические реакции, в которых электроны переходят от одного вещества или его части к другому веществу или к другой части одного и того же вещества, называются окислительно-восстановительными, или red -ox (редокс) процессами.
| Окисление - потеря электронов, т. е. повышение степени окисления Окилитель присоединяет электроны, сам восстанавливается, понижает свою степень окисления | Восстановление - приобретение электронов, т. е. понижение степени окисления Восстановитель отдает электроны, сам окисляется, повышает своею степень окисления |
Любому веществу - окислителю (ox1) соответствует восстановленная форма (red1), а восстановителю (red2)–окисленная форма (ox2), вместе они образуют сопряженную окислительно-восстановительную пару (полуреакцию):
 .
.
Сложение обеих полуреакций позволяет записать в общем виде окислительно-восстановительную реакцию:
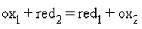 .
.
Окислительно-восстановительные реакции делятся на два типа:
1). Межмолекулярные реакции – протекают с изменением степени окисления атомов в разных молекулах; обмен электронами в этих реакциях происходит между различными атомами или молекулами
2KMnO4 + 5K2SO3 + 3H2SO4 ® 2MnSO4 + 6K2SO4 + 3H2O.
Частный случай межмолекулярных реакции – реакции конпропорционирования, в которых окислитель и восстановитель – один и тот же элемент, но в разных степенях окисления:
3MnSO4 + 2KMnO4 + 2H2O ® 5MnO2 + 2KHSO4 + H2SO4.
2). Ввнутримолекулярные реакции – протекают с изменением степеней окисления атомов в одной и той же молекуле (внутримолекулярные реакции протекают, как правило, при термическом разложении веществ, содержащих окислитель и восстановитель):
(NH4)2Cr2O7 ® N2 + Cr2O3 + 4H2O.
Здесь атомы хрома восстанавливаются (+6 ® +3), а азота - окисляются (-3 ® 0).
Частный случай внутримолекулярных реакций – реакции диспропорционирования (самоокисления – самовосстановления) - окислительно-восстановительные реакции, в которой один элемент одновременно повышает и понижает степень окисления:
3Cl2 + KOH ® 5KCl + KСlO3 + 3H2O.
Соединения, содержащие атомы элементов с максимальной степенью окисления, могут быть только окислителями за счет этих атомов, т.к. они уже отдали все свои валентные электроны и способны только принимать электроны. Максимальная степень окисления атома элемента равна номеру группы в периодической таблице, к которой относится данный элемент. Соединения, содержащие атомы элементов с минимальной степенью окисления, могут служить только восстановителями, поскольку они способны лишь отдавать электроны, потому что внешний энергетический уровень у таких атомов завершен восемью электронами. Минимальная степень окисления у атомов металлов равна 0, для неметаллов - (n–8) (где n- номер группы в периодической системе). Соединения, содержащие атомы элементов с промежуточной степенью окисления, могут быть и окислителями, и восстановителями, в зависимости от партнера, с которым взаимодействуют, и от условий реакции.
Таблица 14.1 - Важнейшие восстановители и окислители
| Восстановители | Окислители |
| а) металлы, водород, уголь; б) анионы, где элемент имеет отрицательную степень окисления:- - галогеноводородные кислоты и их соли, сероводород H2S; в) анионы и катионы, где центральный атом имеет промежуточную степень окисления и его можно еще окислить – окись углерода (II) CO, оксид серы (IV) SO2, сернистая кислота H2SO3 и ее соли, катионы металлов в низших степенях окисления: SnCl2, FeCl2, MnSO4, Cr2(SO4)3, азотистая кислота HNO2, оксид азота(II) NO; г) аммиак NH3; д) гидразин NH2NH2; е) катод при электролизе. | а) электроотрицательные элементы – галогены, кислород; б) вещества, содержащие элементы в высшей степени окисления – перманганат калия KMnO4, бихромат калия K2Cr2O7, хромат калия K2CrO4, азотная кислота HNO3, серная кислота H2SO4 конц,. оксид меди(II) CuO, оксид свинца(IV) PbO2, оксид серебра Ag2O, хлорид железа(III) FeCl3, бертоллетова соль KClO3, хлорид железа(III) FeCl3; в) вещества, содержащие элементы в промежуточной степени окисления –. оксид марганца IV MnO2, пероксид водорода H2O2, азотистая кислота HNO2; г) анод при электролизе. |
Степень окисления – условный (формальный) заряд атома в химическом соединении, который находят, считая химические связи в соединении чисто ионными.
Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью - положительные.
Степень окисления - формальное понятие; в ряде случаев степень окисления не совпадает с валентностью.
Например:
N2H4 (гидразин)
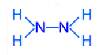
степень окисления азота – минус 2; валентность азота – 3.
Таблица 14.2 - Значения степеней окисления
| Любое простое вещество | |
| В сложных веществах (соединениях): Металлы первой группы главной подгруппы | +1 |
| Элементы второй группы главной подгруппы | +2 |
| Алюминий | +3 |
| Кислород | -2 (кроме пероксидов!!!) |
| Водород | +1 (в соединениях с металлами -1) |
| Фтор | -1 |
В тех случаях, когда степень окисления элемента может иметь разные значения в различных соединениях, её вычисляют исходя из требования: сумма положительных зарядов в молекуле должна быть равна сумме отрицательных зарядов в молекуле, т.е. молекула должна быть электронейтральной:
Na Cl; H S O;
(+1)+(-1)=0 2(+1)+? + 4(-2)=0
K N O; K Cr O.
(+1) +? + 3(-2)=0 2(+1) +? + 7(-2)=0.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 974; Нарушение авторских прав?; Мы поможем в написании вашей работы!