
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Атомные и ионные радиусы
|
|
|
|
Примеры периодического изменения свойств
Поскольку квантовая механика запрещает точное определение координат частицы, понятия “радиус атома”, “радиус иона” условны. Атомные радиусы подразделяют на радиусы атомов металлов, ковалентные радиусы атомов неметаллов и радиусы атомов благородных газов. Их определяют как половину расстояния между слоями атомов в кристаллах соответствующих простых веществ (рис. 2.1) рентгенографическим или нейтронографическим методами.
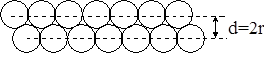
Рис. 2.1. К определению понятия “радиус атома”
В общем случае радиус атома зависит не только от природы атомов, но и от характера химической связи между ними, агрегатного состояния, температуры и ряда других факторов. Это обстоятельство лишний раз указывает на относительность понятия “радиус атома”. Атомы не являются несжимаемыми, неподвижно застывшими шариками, они всегда принимают участие во вращательном и колебательном движении. В табл. 2.1 и 2.2 приведены значения радиусов атомов некоторых металлов и ковалентные радиусы атомов неметаллов.
Таблица 2.1
Атомные радиусы некоторых металлов
| Металл | ra, пм | Металл | ra, пм |
| Li | Rb | ||
| Be | Sr | ||
| Na | Y | ||
| Mg | Zr | ||
| Al | Nb | ||
| K | Mo | ||
| Ca | Tc | ||
| Sc | Ru | ||
| Ti | Rh | ||
| V | Pd | ||
| Cr | Ag | ||
| Mu | Cd | ||
| Fe | In | ||
| Co | Cs | ||
| Ni | Ba | ||
| Cu | La | ||
| Zn | Hf |
Таблица 2.2
Ковалентные радиусы атомов неметаллов
| Элемент | ra, пм | Элемент | ra, пм |
| H | S | ||
| B | Cl | ||
| C | Ge | ||
| N | As | ||
| O | Se | ||
| F | Br | ||
| Si | Te | ||
| P | I |
Радиусы атомов благородных газов значительно больше радиусов атомов неметаллов соответствующих периодов (табл. 2.2), поскольку в кристаллах благородных газов межатомное взаимодействие очень слабое.
Газ He Ne Ar Kr Xe
ra, пм 122 160 191 201 220
Шкала ионных радиусов, понятно, не может быть основана на тех же принципах, что шкала атомных радиусов. Более того, строго говоря, ни одна характеристика индивидуального иона не может быть объективно определена. Поэтому существует несколько шкал ионных радиусов, все они относительны, т. е. построены на основе тех или иных допущений. Современная шкала ионных радиусов основана на допущении, что границей между ионами является точка минимума электронной плотности на линии, соединяющей центры ионов. В табл. 2.3 приведены значения радиусов некоторых ионов.
Таблица 2.3
Радиусы некоторых ионов
| Ион | ri пм | Ион | ri, пм |
| Li+ | Mn2+ | ||
| Be2+ | Mn4+ | ||
| B3+ | Mn7+ | ||
| C4+ | Fe2+ | ||
| N5+ | Fe3+ | ||
| O2– | Co2+ | ||
| F– | Co3+ | ||
| Na+ | Ni2+ | ||
| Mg2+ | Cu+ | ||
| Al3+ | Cu2+ | ||
| Si4+ | Br– | ||
| P5+ | Mo6+ | ||
| S2– | Tc7+ | ||
| Cl– | Ag+ | ||
| Cl5+ | I– | ||
| Cl7+ | Ce3+ | ||
| Cr6+ | Nd3+ | ||
| Lu3+ |
Периодический закон ведёт к следующим закономерностям в изменении атомных и ионных радиусов.
1) В периодах слева направо в целом радиус атома уменьшается, хотя и неравномерно, затем в конце резко возрастает у атома благородного газа.
2) В подгруппах сверху вниз происходит рост радиуса атома: более значительный в главных подгруппах и менее значительный – в побочных. Эти закономерности легко объяснить с позиции электронного строения атома. В периоде при переходе от предыдущего элемента к последующему электроны идут в один и тот же слой и даже в одну и ту же оболочку. Растущий заряд ядра ведёт к более сильному притяжению электронов к ядру, не компенсируемому взаимным отталкиванием электронов. В подгруппах увеличение числа электронных слоёв и экранирование притяжения к ядру внешних электронов глубинными слоями ведёт к росту радиуса атома.
3) Радиус катиона меньше радиуса атома и уменьшается с ростом заряда катиона, например:
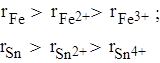
4) Радиус аниона больше радиуса атома, например:
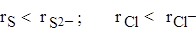
5) В периодах радиусы ионов d-элементов одинакового заряда плавно уменьшаются, это так называемое d-сжатие, например:
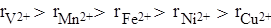
6) Аналогичное явление отмечается и для ионов f-элементов – в периодах радиусы ионов f-элементов одинакового заряда плавно уменьшаются, это так называемое f-сжатие, например:
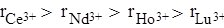
7) Радиусы однотипных ионов (имеющих сходную электронную “макушку”) в подгруппах плавно возрастают, например:
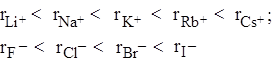
8) Если различные ионы имеют одинаковое число электронов (они называются изоэлектронными), то размер таких ионов, естественно, будет определяться зарядом ядра иона. Наименьшим будет ион с бóльшим зарядом ядра. Например, ионы Cl–, S2–, K+, Cа2+ имеют одинаковое число электронов (18), это изоэлектронные ионы. Наименьшим из них будет ион кальция, поскольку у него наибольший заряд ядра (+20), а наибольшим – ион S2–, у которого наименьший заряд ядра (+16). Таким образом, вырисовывается следующая закономерность: радиус изоэлектронных ионов уменьшается с ростом заряда иона.
Относительная сила кислот и оснований (схема Косселя)
Все кислородные кислоты и основания содержат в составе своих молекул фрагмент Эn+ – О2– – Н+. Хорошо известно, что диссоциация соединения по кислотному или основному типу связана со степенью окисления (более строго, с валентностью) атома элемента. Примем, что связь в этом фрагменте чисто ионная. Это достаточно грубое приближение, поскольку с ростом валентности атома полярность его связей значительно ослабевает (см. гл. 3).
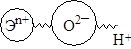
В этом жёстком фрагменте, вырезанном из молекулы кислородной кислоты или основания, место разрыва связи и диссоциация соответственно с выбросом протона или гидроксил-аниона будут определяться величиной взаимодействия между ионами Эn+ и О2–. Чем сильнее это взаимодействие, а оно будет возрастать с увеличением заряда иона (степень окисления) и уменьшением его радиуса, тем более вероятны разрыв связи О–Н и диссоциация по кислотному типу. Таким образом, сила кислородных кислот будет возрастать с увеличением степени окисления атома элемента и уменьшением радиуса его иона.
Отметим, что здесь и далее более сильным из двух является тот электролит, который при одинаковой молярной концентрации в растворе имеет бóльшую степень диcсоциации. Подчеркнём, что в схеме Косселя анализируются два фактора – степень окисления (заряд иона) и радиус иона.
Например, необходимо выяснить, какая из двух кислот более сильная – селеновая H2SeO4 или селенистая H2SeO3. В H2SeO4 степень окисления атома селена (+6) выше, чем в селенистой кислоте (+4). Одновременно радиус иона Sе6+ меньше радиуса иона Sе4+. В результате оба фактора показывают, что селеновая кислота сильнее селенистой.
Еще один пример, марганцевая кислота (HMnO4) и рениевая (HReO4). Степени окисления атомов Mn и Re в этих соединениях одинаковы (+7), поэтому следует сопоставить радиусы ионов Mn7+ и Re7+. Поскольку радиусы однотипных ионов в подгруппе возрастают, делаем вывод, что радиус иона Mn7+ меньше, а значит марганцевая кислота сильнее.
Ситуация с основаниями будет противоположной. Сила оснований возрастает с падением степени окисления атома элемента и увеличением радиуса его иона. Отсюда, если один и тот же элемент образует различные основания, например, ЭОН и Э(ОН)3, то второе из них будет слабее первого, поскольку степень окисления в первом случае меньше, а радиус иона Э+ больше радиуса иона Э3+. В подгруппах сила однотипных оснований будет возрастать. Например, самым сильным основанием из гидроксидов щелочных металлов будет FrOH, а самым слабым – LiOH. Еще раз подчеркнём, что речь идёт о сравнении степеней диссоциации соответствующих электролитов и не касается вопроса об абсолютной силе электролита.
Используем этот же подход при рассмотрении относительной силы бескислородных кислот. Фрагмент Эn– – Н+, имеющийся в молекулах этих соединений, заменяем ионной связью:
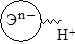
Сила взаимодействия между этими ионами, разумеется, определяется зарядом иона (степенью окисления атома элемента) и его радиусом. Имея в виду закон Кулона, получаем, что сила бескислородных кислот возрастает с уменьшением степени окисления атома элемента и увеличением радиуса его иона.
Сила бескислородных кислот в растворе будет возрастать в подгруппе, например, галогеноводородных кислот, поскольку при одинаковой степени окисления атома элемента увеличивается радиус его иона.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 10206; Нарушение авторских прав?; Мы поможем в написании вашей работы!