
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные положения метода МО
|
|
|
|
1. При соединении двух атомов в молекулу возможны два состояния – две МО: с более низкой энергией (Есвяз) и более высокой энергией (Еразр). Переход электрона на первую орбиталь ведёт к образованию связи (связывающая МО). Переход электрона на вторую орбиталь связи не даёт (разрыхляющая МО) (рис. 5.1). Если атомная орбиталь “переселяется” в молекулу без изменений, т. е. без изменения энергии, она называется несвязывающей.
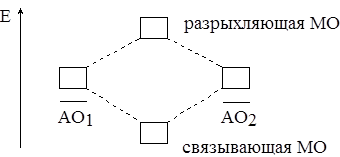
Рис. 5.1. Образование молекулярных орбиталей из атомных орбиталей
2. Метод МО учитывает вклад в химическую связь отдельных электронов.
3. В первом приближении один электрон на разрыхляющей орбитали сводит на нет действие одного связывающего электрона. Отсюда кратность связи равна полуразности числа связывающих и разрыхляющих электронов.
Формы МО представлены на рис. 5.2.
Энергия МО определяется типом АО и характером перекрывания. Перекрёстные перекрывания при рассмотрении гомоядерных двухатомных частиц практически не дают вклада в образование связи. Ограничимся лишь двухатомными частицами (молекулами и ионами) из атомов элементов второго периода. Другими словами, используем базис из атомных орбиталей 1s, 2s, 2p. Из них можно построить десять молекулярных орбиталей, которые располагаются в следующий энергетический ряд:
σ1s < σ1s* < σ2s < σ2s* < σ2pz < π2px = π2py < π2px* = π2py* < σ2pz*
Образование орбиталей σ2s; σ2s*; σ2pz и σ2pz* происходит по одинаковым направлениям, что ведёт к неизбежному взаимодействию орбиталей и


Рис. 5.2. Формы молекулярных орбиталей
дифференциации по энергии. В результате “побеждают” орбитали σ2s и σ2s*, их энергия понижается, но они остаются в энергетическом ряду на том же месте. А вот орбиталь σ2pz (ее энергия повышается) перемещается и оказывается за орбиталями π2px и π2py, имеющими одинаковую энергию. В результате написанный энергетический ряд видоизменяется:
σ1s < σ1s* < σ2s < σ2s* < π2px = π2py < σ2pz < π2px* = π2py* < σ2pz*
Этот энергетический ряд следует учитывать, когда число электронов в молекуле или ионе не больше 14. Если же число электронов 14 и более можно пользоваться любым из приведенных энергетических рядов.
Таким образом, процедура заполнения электронами орбиталей весьма напоминает написание электронных формул атомов, фактически речь идёт о написании электронных формул молекул. Рассмотрим некоторые примеры.
Молекулярный ион Н2+ имеет распределение электронов (σ1s)1, кратность связи составляет 0,5; молекула Н2 запишется (σ1s)2, кратность связи 1.
Молекулярный ион Не2+ имеет распределение электронов (σ1s)2(σ1s*)1, соответственно кратность связи составляет (2–1):2=0,5. Молекула же Не2 существовать не может, кратность связи для такой молекулы равна нулю. Молекулярные ионы Н2+ и Не2+ парамагнитны, молекула водорода – диамагнитна.
Распределение электронов для молекулы В2:
(σ1s)2(σ1s*)2(σ2s)2(σ2s*)2(π2px)1(π2py)1,
здесь имеет место своеобразная аналогия с правилом Хунда – два электрона на двух одинаковых по энергии орбиталях располагаются по одному. Кратность связи в этой молекуле равна (6–4):2=1; она парамагнитна.
Рассмотрим частицы, содержащие по 14 электронов, сюда относятся молекулы N2, CO; ионы CN–, NO+. Такие частицы называются изоэлектронными. Для 14-ти электронных частиц распределение электронов будет:
(σ1s)2(σ1s*)2(σ2s)2(σ2s*)2(π2px)2(π2py)2(σ2pz)2
Отметим, что вместо (σ1s)2(σ1s*)2 можно записать КК, а (π2px)2(π2py)2 заменяется (π2p)4. Кратность связи в этих частицах составляет (10–4):2=3, и мы без труда и привлечения сомнительных соображений объяснили тройную связь в молекуле СО!
Метод ВС, правомерно предсказывая двойную связь в молекуле кислорода, не способен объяснить парамагнетизм этого вещества. В методе МО эта проблема снимается, ведь согласно распределению электронов по молекулярным орбиталям
КК (σ2s)2(σ2s*)2(π2p)4(σ2pz)2(π2px*)1(π2py*)1
имеются два неспаренных электрона на разрыхляющих орбиталях.
Здесь мы качественно (в первом приближении) познакомились с элементами метода МО в простейшем варианте. Для более сложных частиц принципы построения одноэлектронных волновых функций будут несколько иными, в частности используется понятие о групповой орбитали и многоцентровой связи.
Действительно, до сих пор мы трактовали химическую связь как связывающую лишь два ядра, т. е. как двухцентровую. Существует масса молекул, для объяснения химической связи в которых не достаточно представлений о двухцентровой химической связи. Типичными примерами таких молекул являются бороводороды.
Простейший из них – диборан В2Н6. Частица ВН3 существует (валентные возможности атома бора 1 и 3), однако процесс её димеризации самопроизволен. В молекуле диборана два атома бора и четыре атома водорода лежат в одной плоскости, а два других атома водорода – над этой плоскостью и под ней, каждый из этих атомов водорода связан с двумя атомами бора (рис. 5.3).

Рис. 5.3. Молекула диборана
Это легко доказывается тем, что первые четыре атома водорода могут быть замещены на другие атомы или группировки без нарушения целостности молекулы диборана, тогда как попытка заместить два других атома водорода неизбежно ведет к разрушению молекулы диборана.
Таким образом, для образования связи атома водорода с двумя атомами бора имеется только два электрона. Про такую молекулу говорят электронодефицитная или орбитально-избыточная; число валентных электронов меньше, чем 2(n–1), n – число связанных атомов. Два электрона образуют связи между тремя атомами – двухэлектронная трехцентровая связь (рис. 5.3).
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2486; Нарушение авторских прав?; Мы поможем в написании вашей работы!