КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
План лекции
|
|
|
|
Гаплоидная технология
Лекция 10
Цель: изучить особенности гаплоидной технологии, рассмотреть гиногенез и андрогенез, механизмы развития гаплоидов in vitro.
1. Получение гаплоидных культур
2. Индуцирование гаплоидов в культуре мужского гаметофита.
2.1 Развитие микроспор in vitro и in vivo
2.2 Факторы, влияющие на андрогенез in vitro
3. Получение гаплоидных растений в культуре женского гаметофита
3.1 Женский гаметофит растений и его развитие in vitro
3.2 Факторы, влияющие на гиногенез
1 В настоящее время наблюдается тенденция обеднения генофонда важнейших растительных культур. Посевные площади начинают занимать генетически гомогенные суперсорта, что приводит к сужению генофонда для селекции. В этой ситуации возрастет значение метода отдаленной гибридизации, решающего проблему пополнения генофонда культурных видов. Однако, возможности отдаленной гибридизации ограничиваются из-за прогамной и постгамной генетической несовместимости, для преодоления которых успешно применяется метод культуры изолированных зародышей и оплодотворения in vitro.
Эмбриокультура спасает от гибели нежизнеспособные зародыши межвидовых и межродовых гибридов, постепенно становится незаменимым методом преодоления постгамной несовместимости. Этим методом получены многие межвидовые и межродовые гибриды. Успешное культивирование недоразвитых изолированных зародышей зависит от многих факторов и, прежде всего, от стадии развития, степени дифференцировки зародышей в момент изоляции. Трудность выращивания изолированных недифференцированных зародышей обусловлена невозможностью воспроизведения in vitro гормональной функции эндосперма. Существование тесной функциональной связи между зародышем и эндоспермом, особенно в раннем эмбриогенезе было обнаружено именно при культивировании зародышей.
Сравнительное изучение зародышей различных видов в естественных условиях и в культуре, выявило важный этап в ходе эмбриогенеза - автономность развития зародыша, начиная с которой он становится независимым от материнского организма и способен пройти дальнейший эмбриогенез и дать нормальный росток. Определение фазы автономности для каждого вида растений очень важно, потому что с этого времени зародыш может развиваться самостоятельно на питательной среде. Успешное культивирование недоразвитых изолированных зародышей зависит от создания такой питательной среды, которая позволяет закончить формирование и перейти к прорастанию. Универсальной питательной среды для культивирования зародышей нет, поэтому подбор и оптимизация питательной среды является важной процедурой в эмбриокультуре.
Еще одним способом получения растений из зародышей, находящихся на самых ранних стадиях развития, является выращивание in vitro оплодотворенных семяпочек и завязей. При этом почти исключается опасность механического повреждения развивающихся в них зародышей при изоляции и появляется возможность культивировать объекты начиная со стадии зиготы. Эмбриогенез в семяпочках in vitro протекает нормально, если в момент отделения семяпочки присутствует минимальное число ядер эндосперма. При изолировании семяпочки из завязи эмбриогенез протекает нормально даже из семяпочки с зиготой, потому что in vitro образуется эндосперм под влиянием морфогенетического фактора, поступающего из плаценты.
Кроме повышения жизнеспособности зародыша при отдаленной гибридизации эмбриокультура может быть применена для ускорения селекционного процесса путем прерывания состояния покоя семян, сокращения цикла размножения растений, преодоления самостерильности семян.
Благодаря развитию методов культивирования репродуктивных органов стало возможным преодоление также и прогамной несовместимости путем совместной культуры пыльцы и неоплодотворенных семяпочек. За день до раскрытия цветков бутоны срезают, стерилизуют, вычленяют из них пестик или завязь, или семяпочку с плацентой и помещают на питательную среду, предварительно сделав надрез в стенке завязи и обнажив семяпочку. Затем на агар около семяпочки высевают простерилизованную пыльцу, которая прорастая попадает через микропиле семяпочки в зародышевый мешок. Развитие зародыша при оплодотворении в пробирке может протекать нормально. Иногда упрощают эту процедуру, нанося пыльцу на семяпочку и культивируя опыленную семяпочку. Опыление in vitro хорошо удается для растений семейства маковых, гвоздичных, пасленовых, у которых в завязях имеются многочисленные семяпочки.
Дальнейшая разработка методов культивирования генеративных органов цветка в сочетании с эмбриокультурой позволит вести селекцию более эффективно, ибо возрастают возможности для осуществления отдаленной гибридизации.
Для получения гаплоидных растений, представляющих ценный исходный материал для селекции удобно использовать культуру репродуктивных органов пыльников, неоплодотворенных завязей и семяпочек. Основным преимуществом гаплоидной технологии является быстрое получение гомозиготных линий. Такие линии происходят либо из отцовского, либо из материнского геномов репродуктивных клеток, имеют максимальную гомозиготность в отличии от соматических клеток для которых характерна гетерозиготность. Значение гаплоидной технологии было сразу оценено селекционерами из-за значительного сокращения времени для создания гомозиготных линий и получения быстрой информации о ценности тех или иных комбинаций в ранних поколениях.
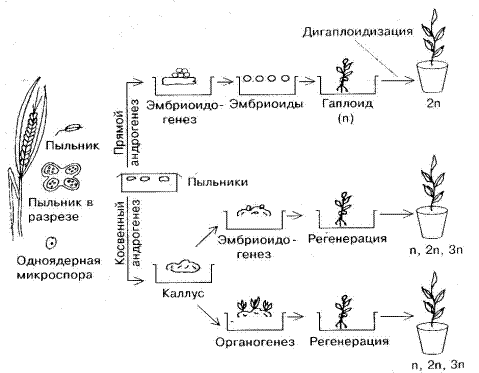
Гаплоидные растения при культивировании пыльников получены более чем у 70 видов, в том числе у пшеницы, ячменя, риса, кукурузы. Поскольку гаплоиды, полученные в культуре пыльников несут генотип мужской гаметы, этот процесс называется андрогенезом in vitro. Андрогенез может быть прямым и косвенным. Прямой андрогенез – образование гаплоидных растений-регенерантов благодаря пыльцевому эмбриогенезу, то есть из эмбриоидов, формирующихся путем деления микроспор. Возникновение гаплоидных растений из каллусов, которые образуются в результате дифференциации микроспор, называется косвенным андрогенезом. Не все растения, регенерировавшие из каллусов, являются гаплоидными, поэтому для массового получения гаплоидов необходимо индуцировать пыльцевой эмбриогенез.
В клетках культивируемых пыльников могут идти следующие процессы:
1. эмбриоидогенез;
2. дифференциация и каллусогенез;
3. возникают структуры шаровидной формы, из которых не регенерируют растения;
4. продолжение микроспорогенеза и гаметогенеза;
5. деградация микроспор.
Растения-регенеранты, в том числе гаплоидные, появляются благодаря двум первым процессам.
При нормальном развитии пыльцы in vitro одноядерные микроспоры претерпевают асимметричное деление с образованием генеративной и вегетативной клеток. Вегетативная клетка в дальнейшем остается в состоянии покоя, тогда как генеративная клетка делится, образуя два спермия. В пыльцевых зернах на поздних стадиях запрограммирован гаметофитный путь с образованием спермиев.
Только молодые микроспоры или пыльца, произошедшие непосредственно после первого митоза могут быть индуцированы для перехода на спорофитный путь развития in vitro. При выделении пыльников из цветочных бутонов и помещения их на питательную среду индуцируется спорофитный путь развития микроспор. Внутри пыльника происходят многочисленные деления микроспор и образуется многоклеточный комплекс, из которого формируются различные андрогенные структуру (глобулы, эмбриоиды), дающие начало гаплоидным растениям.
Как же происходит развитие микроспор in vitro? Выяснено 4 основных пути андрогенеза:
1 путь. Микроспора делится на две идентичные дочерние клетки, которые способны к спорофитному развитию. В данном случае не происходит формирования вегетативных и генеративных клеток.
2 путь. Микроспора в результате неравного деления образует вегетативную и генеративную клетки. Спорофиты возникают в результате дальнейшего развития вегетативной клетки, а генеративная клетка дегенерирует (разрушается).
3 путь. Эмбриоиды формируются только из генеративной клетки. В таких случаях вегетативная клетка либо вовсе не делится, либо делится до известного предела.
4 путь. Как и во втором случае, в результате деления одноядерной микроспоры образуются вегетативная и генеративная клетки, которые в дальнейшем делятся и участвуют в развитии спорофита. Затем возможно непосредственное формирование эмбриоидов или образовании спорофитов путем регенерации из каллуса.
Наряду с развитием культуры пыльников и микроспор (андрогенез) в последнее время уделяется большое внимание и культивированию неоплодотворенных завязей и семяпочек, а также зародышевых мешков (гиногенез). Это направление имеет ряд преимуществ перед андрогенезом:
1. получение гаплоидов у мужских стерильных растений возможно только через гиногенез;
2. женский гаметофит является источником гаплоидов у тех растений, у которых андрогенный каллус обладает низкой морфогенетической потенцией или приводит к образованию альбиносов;
3. Зародышевый мешок в отличие от микроспор способен к индукции спорофита на всех стадиях развития.
Новый организм в норме может возникнуть только из зиготы - оплодотворенной яйцеклетки. Однако, в определенных условиях в клетках зародышевого мешка может быть нарушен генетически запрограммированный цикл развития, и начало новому организму, кроме яйцеклетки могут дать и другие элементы зародышевого мешка (синергиды, антиподы). При этом образуются апомиктические зародыши, которые наследуют признаки только материнского организма. Это явление имеет важное значение, так как образующийся зародыш наследует признаки только материнского организма, что и вызвало развитие метода гиногенеза. Культура неоплодотворенных завязей и семяпочек открывает большие возможности для получения гиногенетических гаплоидов (дигаплоидов). Наибольший простор это направление открывает для исследования фундаментальных механизмов реализации морфогенетических потенций клеток и для прикладных разработок по созданию новых исходных форм растений.
Вошло в селекционную практику также получение гаплоидов методом селективной элиминации хромосом в гибридном зародыше. При скрещивании культурного ячменя (Hordeum vulgare) с диким луковичным ячменем Hordeum bulbosum возникают гаплоиды с набором хромосом Hordeum vulgare. На стадии начала роста зародыша и эндосперма происходит элиминация хромосом дикого вида. Гаплоиды возникают из опыляемых растений в обоих случаях скрещивания, когда Hordeum bulbosum служат как материнской, так и отцовской формой. В первом случае появляются гаплоиды дикого вида, во втором – гаплоиды культурного ячменя, что весьма существенно для селекции. Так как гаплоиды стерильны, для получения фертильных растений гаплоиды обязательно должны быть переведены на диплоидный уровень. Дигаплоид, полученный из гаплоидного организма является абсолютно гомозиготным. Использование гибридизации с ячменем луковичным и удвоение хромосом резко сокращает время, необходимое для получения гомозигот. Гаплоиды очень ценны также для мутационной селекции, потому что на гаплоидном уровне облегчается идентификации генетических изменений.
2 Гаплоиды – организмы, в соматических клетках которых содержится одинарный набор хромосом (n), представляющий половину полного набора (2n), свойственного виду. Экспериментальное получение гаплоидов традиционными методами селекции (внутривидовое или межвидовое опыление, облучение рентгеновскими лучами и воздействие другими стрессовыми факторами) малоэффективно и требует много времени. Использование таких приемов, как культивирование in vitro мужского и женского гаметофита, намного ускоряет получение гаплоидов и облегчает селекционный процесс. Экспериментальную гаплоидию можно рассматривать как форму апомиксиса. Апомиксис- размножение организмов, не сопровождающееся половым процессом.
Индуцирование гаплоидов в культуре мужского гаметофита (пыльники, пыльца) называется андрогенезом, в культуре женского гаметофита (семяпочки) гиногенезом. Кроме того, гаплоиды можно вырастить культивируя гибридный зародыш, в котором происходит элиминация хромосом одного из родителей. Иногда гаплоидное растение образуется в процессе псевдогамии – ложного оплодотворения, в результате чего зародыш развивается из неоплодотворенной яйцеклетки.
Впервые гаплоидные растения при культивировании пыльников дурмана были получены С. Гуха и С. Махешвари в Индии в 1964 году. Затем эти опыты повторил на табаке французский ученый К. Нич в 1957 г. С тех пор этим способом получены гаплоидные растения более чем у 200 видов, в том числе у пшеницы, ячменя, ржи, риса, картофеля, рапса и других сельскохозяйственных культур.
Возникновение in vitro гаплоидного сапрофита из мужского гаметофита - процесс сложный и слабоизученный. Микроспоры проходят очень сложный путь, формируя либо каллус, либо эмбриоиды и далее растения-регенеранты. Как индуцируется и регулируется процесс, пока неизвестно.
Нормальное развитие микроспор in vivo складывается из следующих стадий: 1) мейоз, в результате которого из материнской клетки пыльцы образуются тетрады микроспор; 2) освобождение микроспор из утолщенной стенки тетрады; 3) развитие микроспоры с последующим образованием зрелого пыльцевого зерна, сопровождаемое двумя митозами. В культуре отклонение от нормального развития может идти на любой стадии развития микроспоры.
2.1 Микроспоры (незрелая пыльца) in vitro ведут себя по-разному. Единицы из них переходят с гаметофитного пути развития на спорофитный и формируют эмбриоид. Другие дедифференцируются и образуют каллус. Часть из них может продолжать микроспорогенез и гаметогенез, а какая-то часть вообще деградирует и погибает. Н. Сандерланд исследовал первые этапы развития изолированных микроспор дурмана в культуре и показал, что они отличаются от нормального развития микроспор (рис. 10). Микроспора in vitro может разделиться на две «равные» клетки (путь развития Б), то есть не происходит дифференцирующего деления с образованием вегетативной и генеративной клетки.
Такой переход с гаметофитного на сапрофитный путь развития характерен для Datura innoxia, Nicotiana tabacum.
Одноядерная микроспора в результате первого неравного деления образует вегетативную и генеративную клетки (путь развития А). Генеративная клетка после первого митотического деления дегенерирует и все последующее развитие микроспоры идет по зиготическому пути через многократное деление вегетативной клетки (А-В путь). Этот путь развития наблюдается у Nicotiana tabacum, Datura metel, Hordeum vulgare, Triticum aestivum и др. В других случаях может делиться только генеративная клетка (А-Г путь). Возможно, что обе клетки (вегетативная и генеративная) делятся и участвуют в образовании спорофита (А-ГВ путь). Описанные пути развития микроспоры in vitro приводят к образованию гаплоидной многоклеточной структуры, из которой в дальнейшем сформируется гаплоидное растение-регенерант.
В случае же слияния вегетативного ядра с генеративным (путь Ц), спорофит, развившийся из диплоидной клетки, будет диплоидным.
Кроме того, диплоиды могут возникать из нередуцированных микроспор, которые имели аномалии в развити (нарушения в мейозе), а также в результате эндополиплоидии на последующих стадиях формирования спорофита. Трудно сказать, что является индуктором переключения программы развития микроспоры с гаметофитного на спорофитный путь, участвуют в этом процессе нормальные или аномальные микроспоры. Поведение микроспор определяется многими факторами, в том числе их естественным полиморфизмом, причиной которого могут быть аномалии в развитии, позиционное положение веретена деления в спорах.
Процесс перехода микроспор с гаметофитного на спорофитный путь развития определяется на генетическом уровне, но реализуется в зависимости от конкретных физиологических условий и различных по действию индуцирующих факторов. Направление развития микроспор прежде всего определяется стадией, на которой были изолированы пыльники, а также гормональным составом питательной среды.
Образовавшаяся из микроспоры многоклеточная структура далее может развиться в каллусную ткань. Образование гаплоидных растений из эмбриоидов называется прямым андрогенезом, из каллуса – косвенным (рис.11).
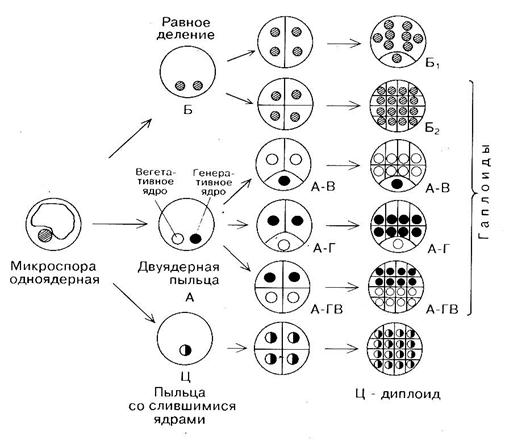
Рисунок 10 – Схема развития микроспоры по спорофитному пути с образованием эмбриоидов или каллусной ткани
Из тысяч микроспор, содержащихся в пыльнике, только из единиц развиваются эмбриоиды. Возможно, способность к эмбриоидогенезу генетически обусловлена. Экспериментально установлено увеличение частоты эмбриогенных микроспор под действием стрессовых воздействий, например, низких и высоких температур, ионизирующих излучений. Для прямого андрогенеза имеет значение физиологическое состояние донора, стадия развития пыльцы в момент введения пыльника в культуру, состав питательной среды и условия культивирования. Для многих растений наиболее благоприятной стадией развития является одноядерная микроспора.
Не все растения, регенерировавшие из каллусов, являются гаплоидными, поэтому для массового получения гаплоидов стараются индуцировать пыльцевой эмбриоидогенез.
В.Ананд с сотрудниками, культивируя пыльники одного из сортов виргинского табака Nicotiana tabacum, наблюдали образование эмбриоидов трех типов: путем деления вегетативной клетки, генеративной и обеих клеток.
|
Рисунок 10
|
Из этих эмбриоидов они получили растения и выращивали их далее в почве до цветения. Морфологический анализ листьев и цветков показал, что эти растения также подразделялись на три типа. Установлено, что в культуре пыльников и микроспор образуется два типа каллусов: каллусы, содержащие неорганизованную массу гетерогенных клеток, и каллусы, состоящие частично из меристематических клеток. Процесс регенерации связан со вторым типом каллусов, у которых образование побегов происходит из меристематических очагов путем последующей дифференциации.
Были проведены различные эксперименты, свидетельствующие о том, что начальные этапы морфогенеза зависят от положения исходных микроспор в археспорангии. Регенерация растений происходила как из эмбриоидов, так и путем органогенеза из морфогенных каллусов, которые образовывались как из первичного каллуса, так и в результате дедифференциации глобул и эмбриоидов.
Развитие микроспор пшеницы in vitro осуществлено Б. Б. Анапияевым в КазНУ им. аль-Фараби. Установлена возможность прямого эмбриоидогенеза в культуре изолированных пыльников и микроспор пшеницы. В развитии андроклинных структур (эмбриоиды и каллусы) выявлены критические периоды: а) первый митоз и последующие, формирование многоклеточного комплекса; б) стадия глобулы; в) стадия проэмбрио. На критических этапах своего развития эмбриоиды могут дедифференцироваться в каллус, в этом случае регенерация растений происходит через вторичный эмбриоидогенез или органогенез (геммогенез, гемморизогенез).
2.2 Получение андрогенных гаплоидов in vitro сопряжено со многими трудностями из-за слабой теоретической изученности проблемы. Мы не знаем, как идет регуляция морфофизиологических процессов внутренними и внешними факторами на разных стадиях развития микроспоры, какие нужны условия для реализации тотипотентности микроспор и т.д. Это заставляет исследователей действовать эмпирически, подбирая оптимальные условия и корректируя их для разных видов и сортов растений.
Продуктивность андрогенеза in vitro зависит от многих взаимосвязанных факторов: генотипа донорного растения, условий его выращивания, стадии развития микроспор, предобработки эксплантов, состава питательных сред, режима культивирования и др.
Одним из основных факторов, лимитирующих андрогенез in vitro, является генотип донорного растения. Причем не только внутри рода, но и сорта одних и тех же видов обнаруживают различную способность к регенерации растений. Например, пыльники сортов риса японского подвида намного более продуктивны, чем пыльники индийского подвида. В исследованиях И.С. Рахимбаева с сотрудниками в КазГУ при испытании 27 генотипов ячменя и 24 генотипов пшеницы андрогенетическая способность в культуре пыльников варьировала на разных питательных средах в пределах соответственно от 0 до 31,6 и от 0 до 14,7 %.
Результаты многих исследований показывают, что взаимосвязь между генотипом и морфогенезом in vitro является сложной, особенно это касается однодольных растений. И. Васил считает, что физиологическое состояние экспланта на момент изолирования оказывает большое влияние на его морфогенетические способности, чем генотип. Оптимизация условий культивирования с учетом физиологического состояния экспланта может снизить влияние генотипа на андрогенез in vitro. Как подтверждение этой предпосылки выступают установленные факты о влиянии на эффективность андрогенеза in vitro условий выращивания донорных растений. Так, например, регенерация растений идет лучше в культуре пыльников, выделенных из растений, выращенных в поле, чем в теплице. По-видимому, это результат комплексного влияния факторов внешней среды.
Оптимальные условия выращивания доноров различаются для каждого вида растения. Имеются примеры положительного влияния на частоту индукции каллусов и эмбриоидов из микроспор действия различных физических и химических факторов на растения-доноры (низкие и высокие температуры, недостаток азота в питании, лазерная обработка и др.). Среди этих факторов особо значимым является температурный. Холодовая предобработка растений-доноров, колосьев, пыльников способствует сохранению жизнеспособности пыльцы и увеличивает частоту образования эмбриоидов. Вместе с тем не существует стандартных рекомендаций по режиму предобработки. Температура и продолжительность обработки зависят от вида, стадии развития пыльцы, временем ее сбора. Однако, в литературе встречаются факты отрицательного воздействия низких температур на андрогенез. Иногда положительный эффект дают инкубация пыльников при повышенной температуре, например 30 оС для рапса, или последовательная холодовая и высокотемпературная их обработка, в частности для горчицы.
Решающую роль для индукции андрогенеза in vitro играет стадия развития микроспор в момент их изоляции для культивирования. В зависимости от вида растений наиболее благоприятны стадии между концом мейоза и поздней двуядерной стадией. При переносе пыльников в культуру на оптимальной стадии развития наблюдаются преимущественный пыльцевой эмбриогенез и формирование растений.
У различных растений установлено существование определенной фракции микроспор, способных к эмбриоидогенезу in vitro, так называемых Р-зерен. Они существуют in vivo и отличаются от других типов микроспор меньшими размерами, отсутствием крахмала, светлой цитоплазмой, иногда дополнительными митозами, вследствие чего могут быть многоядерными. Это явление получило название пыльцевого диморфизма.
Питательная среда и условия культивирования имеют большое значение для эффективности андрогенеза in vitro. Чаще всего используют основные среды Мурасиге и Скуга, Гамборга, агаризованные или жидкие. На жидкой среде каллусогенез из микроспор идет быстрее и лучше, но эффективность регенерации растений ниже, поэтому чаще применяют поверхностное культивирование пыльников.
В зависимости от вида питательной среды (твердая, жидкая) и площади ее поверхности зависит плотность посадки пыльников. Так, при культивировании пыльников ячменя в жидкой среде в чашках Петри в каждом миллилитре среды должно быть не менее 60 пыльников. Плотность посадки пыльников на твердую среду в пробирках – 18-20 штук, в чашках Петри диаметром 40-60 мм – 60-80 штук.
Содержание сахарозы в среде варьируется в зависимости от вида растения от 2 до 12 %.
В зависимости от вида растений и стадии развития микроспоры варьируется гормональный состав среды.
3 Работы по культивированию женских репродуктивных органов с целью получения гаплоидных растений начались еще в 50-е годы, и в последние годы интерес к культуре женского гаметофита особенно возрос. Это, во-первых, обусловлено тем, что культивирование неоплодотворенных семяпочек мужских стерильных растений является единственной возможностью получения у них гаплоидов. У мужских стерильных линий табака и сахарной свеклы эти методом получены гаплоидные растения. Во-вторых, женский гаметофит может быть источником получения гаплоидов у тех растений, у которых каллусная ткань обладает низким морфогенетическим потенциалом либо регенерирует растения-альбиносы. У некоторых растений в культуре семяпочек частота регенерации зеленых растений значительно выше, чем из пыльников. Например, у ячменя все гаплоидные растения, индуцированные через гиногенез, оказались хлорофиллоносными, в то время как при андрогенезе 99 % растений-регенерантов были альбиносами.
Индуцирование гаплоидов в культуре семяпочки называется гиногенезом и является одной из форм апомиксиса. Апомиксис – это размножение организмов, не сопровождающееся половым процессом. В зависимости от того, дает начало новому организму половая или вегетативная клетка, различают две основные формы апомиксиса партеногенез и апогамию.
Партеногенез – это форма полового размножения организмов, при которой женские половые клетки (яйцеклетки, яйца) развиваются без оплодотворения. Партеногенез – половое, но однополое размножение, потомство повторяет генотип матери. Зародыш может быть как гаплоидный, так и диплоидный. Апогамия (апогаметия) – гаметы не образуются, а зародыш (гаплоидный или диплоидный) развивается из синергиды или антиподы.
3.1 Женский гаметофит растений – зародышевый мешок располагается в семяпочке и окружен нуцеллусом и интегументами (покровами), образующими при смыкании узкий канал – микропиле, противоположная микропиле часть семяпочки называется халазой (рис.12). Халазной стороной семяпочка через семяножку прикрепляется к плаценте.
Семяпочки цветковых растений образуются в завязи. Типичный зародышевый мешок, так называемый нормальный тип, развивается из одной мегаспоры, дифференцирующейся в нуцеллусе семяпочки, которая разрастаясь, трижды делится и превращается в 7-клеточное 8-ядерное тело с упорядоченным расположение клеток.
Зародышевый мешок состоит из крупной яйцеклетки и прилегающих к ней двух менее развитых вспомогательных клеток – синергид. Ближе к центру располагается двуядерная центральная клетка, у халазального полюса – три одинаковые клетки – антиподы. В нормальном типе зародышевого мешка ядра всех клеток, за исключением центральной, гаплоидные. Центральная клетка содержит два гаплоидных ядра, которые затем сливаются и образуют диплоидное ядро. В результате двойного оплодотворения из яйцеклетки образуется диплоидная зигота, дающая начало зародышу, а из центральной клетки развивается триплоидный эндосперм.
Зародышевый мешок в морфологическом и физиологическом отношении представляет собой более сложную структуру, чем пыльцевое зерно. В связи с этим индукция гаплоидных растений в культуре женского гаметофита имеет свои особенности.
В ранних работах по культивированию завязей и семяпочек наблюдалась только пролиферация соматических тканей, окружающих зародышевый мешок. Впервые гаплоидный каллус был получен Тулеком в 1964 г. в культуре женского гаметофита представителя голосеменных растений –гинкго.
Гаплоидный набор хромосом в каллусе свидетельствует о том, что каллус индуцирован из гаплоидных клеток зародышевого мешка. Однако попытки индуцировать органогенез в этом каллусе не увенчались успехом.
|

Рисунок 12 - Поперечный срез семяпочки ортотропного типа
У покрытосеменных гаплоидный каллус был индуцирован японскими исследователями в 1971 г. в культуре неоплодотворенных семяпочек баклажана и в культуре завязи кукурузы. Но они тоже не смогли получить растения-регенеранты. Получить нормальные зеленые гаплоидные в культуре неоплодотворенных завязей ячменя впервые удалось Сан Ноуму в 1976 г. С тех пор проведены многочисленные эксперименты по индуцированию гаплоидных растений в культуре неоплодотворенных завязей и семяпочек различных видов покрытосеменных растений.
Показано, что формирование гаплоидных растений является результатом аномального развития женского гаметофита и осуществляется двумя способами: через эмбриоидогенез и каллусогенез. Как и в культуре пыльников, получение гаплоидных растений в культуре семяпочек предпочтительнее через эмбриоидогенез.
В норме новый организм возникает из зиготы, но явление апомиксиса, наблюдаемое в природе, свидетельствует о том, что начало новому организму может дать и неоплодотворенная яйцеклетка (партеногенез), а также и другие клетки зародышевого мешка (апогамия).
Видимо, при создании в завязи и семяпочке каких-то, пока неизвестных, условий в клетках зародышевого мешка нарушается генетически запрограммированный цикл развития. В результате отдельные клетки выходят из состояния тупиковой дифференцировки и приобретают способность к дальнейшему развитию, образуя апомиктические зародыши. Ценность этих зародышей состоит в том, что они наследуют только признаки материнского растения. По-видимому, такие же процессы протекают в культурах in vitro у изолированных неоплодотворенных завязей и семяпочек.
Гаплоидные эмбриоиды или каллус также могут иметь различное происхождение, то есть возникать сразу из нескольких или только из единственной клетки зародышевого мешка. Развитие эмбриоидов из клеток зародышевого мешка отмечалось у ячменя, риса, пшеницы, кукурузы, сахарной свеклы, табака, гевеи.
Сан Ноум, изучая индукцию гаплоидных растений в культуре неоплодотворенных завязей ячменя, обнаружил, что эмбриоиды образуются различными путями: из яйцеклетки и антипод, из антипод, из яйцеклетки и одной синергиды, из яйцеклетки и двух синергид, из одной или двух синергид, из синергид и антипод, из яйцеклетки и антипод. Он полагает, что гаплоидные эмбриоиды у ячменя формируются преимущественно из антипод, а клетки каллусного типа образуются из синергид.
В культуре неоплодотворенных завязей риса наблюдали индукцию гаплоидного эмбриогенеза и каллусогенеза в основном из синергид, антиподы при этом не изменялись, но затем они несколько раз делились или совсем дегенерировали. У табака в культуре неоплодотворенных семяпочек гаплоидные эмбриоиды возникали в результате деления яйцеклетки, а у скерды – из антипод. Причины или факторы, побуждающие элементы зародышевого мешка in vitro дедиференцироваться или переключаться на незапрограммированный путь дифференцировки, остаются пока не выясненными.
Цитогенетические исследования культивируемых завязей и семяпочек показали, что in vitro индуцируются к пролиферации и клетки соматических тканей, окружающие зародышевый мешок. Из нуцеллуса и интегументов формируются диплоидные и полиплоидные растения. Нуцеллярная эмбриония (развития зародыша из нуцеллуса) часто встречается в природе у цитрусовых и манго. Полиэмбрионию в культуре нуцеллуса удалось индуцировать у несколько видов лимона, а также у винограда.
С.К. Мухамбетжанов в Институте физиологии, генетики и биоинженерии растений НАН РК изучал рост им морфогенез в культуре неоплодотворенных завязей пшеницы. Он показал, что программа морфогенеза реализовалась на основе процессов каллусогенеза, органогенеза и эмбриоидогенеза. Апомиксис у пшеницы in vitro осуществляется на основе «переключения» клеток женского гаметофита на спорофитный путь развития. При этом в клетках зародышевого мешка и окружающих его тканей могут протекать следующие морфогенетические процессы: гиногенез (из яйцеклетки), апогаметия (из синергид и антипод), адвентивная эмбриония (из клеток нуцеллуса или интегументов).
Таким образом, при культивировании неоплодотворенных завязей и семяпочек не исключена возможность индукции каллуса из диплоидных клеток соматических тканей. Конечно, лучше было бы культивировать непосредственно зародышевый мешок, но вычленить его без повреждения очень трудно. Выделить семяпочку в зависимости от вида растений можно механическим либо ферментативным путем, растворяя окружающие ткани пектиназами. Однако до настоящего времени попытки не увенчались успехом в связи с тем, что выделенный зародышевый мешок характеризуется низкой жизнеспособностью. Возможно, окружающие зародышевый мешок соматические ткани способствуют повышению жизнеспособности зародышевого мешка и даже оказывают положительное влияние на индукцию гаплоидного эмбриоидо-и каллусогенеза.
В связи с вышеизложенным, в некоторых случаях более эффективно получение гаплоидных растений с материнскими свойствами не путем гиногенеза, то есть в культуре семяпочки, а в процессе псевдогамии. Это специфический случай гаплоидного партеногенеза, когда для индукции гаплоидного развития необходимо опыление пыльцой. Вследствие селективной элиминации хромосом дикого ячменя растение-регенерант развивается фактически из яйцеклетки и обладает всеми материнскими признаками. Партеногенетическое развитие яйцеклетки возможно также при опылении пыльцой, обработанной ионизирующим излучением.
3.2 На процесс индукции гаплоидных растений влияет целый комплекс лимитирующих факторов. Среди них можно выделить факторы эндогенные (генотип исходного растения, степень развития зародышевого мешка) и экзогенные (состав питательной среды, условия культивирования).
При разработке методов получения гаплоидных растений в культуре завязей и семяпочек, как и при культивировании пыльников, необходимо учитывать эффект генотипа донорного растения. Эмпирически подобранные условия получения гаплоидов для одного сорта оказываются непригодными для других и требует существенных модификаций.
Другим фактором, определяющим развитие неоплодотворенных завязей и семяпочек в культуре, является стадия развития женского гаметофита.
Правильный подбор питательных сред является важным фактором. Чаще всего используются среды МС, Миллера, Нича, № 6. Определяющее значение имеет тип и количество фитогормонов. Для одних видов необходимы в определенном сочетании ауксины и цитокинины, очень высокие концентрации фитогормонов в питательной среде в большей степени стимулируют каллусогенез из соматических тканей завязи, чем из гаплоидных элементов зародышевого мешка.
Определенную роль играют витамины, гидролизат казеина, дрожжевой экстракт и другие натуральные экстракты. Существенное значение имеет присутствие в среде углеводов.
Таким образом, при культивировании завязей и семяпочек подбор оптимального уровня компонентов питательной среды, особенно стимулирующих рост веществ, осуществляется эмпирически для каждого конкретного вида и даже сорта растения.
Обычно завязи и семяпочки выращивают поверхностным способом, но в опытах на рисе, хлопчатнике показана возможность их культивировать в жидких средах. Культивирование осуществляют при температуре 23-28 оС при освещении или в темноте с подбором оптимального температурного и светового режима для каждого конкретного эксперимента.
Контрольные вопросы:
1. Методы гаплоидии.
2. Развитие микроспор in vivo и in vitro.
3. Какие факторы влияют на андрогенез in vitro.
4. Развитие женского гаметофита in vitro.
5. Влияние факторов на гиногенез.
6. Что называется эмбриокультурой?
7. Как получить культуру растительных эмбриокультур?
8. Какие вопросы можно решить с использованием методов гаплоидной технологии?
9. Какие процессы можно наблюдать при культивировании пыльников?
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 3855; Нарушение авторских прав?; Мы поможем в написании вашей работы!