
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Криосохранение клеток
|
|
|
|
Лекция 15
Цель: рассмотреть методы хранения культуры клеток, преимущества криосохранения клеток растений, основные этапы, а также трудности, возникающие в связи с особенностями растительных клеток.
План лекции:
1. Замедление роста клеток
2. Основные этапы криосохранения
2.1 Подготовка культуры
2.2 Замораживание и хранение
2.3 Оттаивание и удаление криопротектора
2.4 Рекультивирование клеток и их оценка после криосохранения
1 В настоящее время осуществляется создание новых сортов растений и регулярная смена, что связано, в первую очередь, с утратой сортом ценных признаков, появлением новых популяций вредителей и возбудителей болезней, изменением климата, почвы и множеством других причин. Средний срок жизни сорта пшеницы и других зерновых культур обычно 5-10 лет. Для выведения новых сортов и улучшения старых требуется разнообразный генетический материал. В целях сохранения генофонда редких и исчезающих видов, ценных селекционных объектов и штаммов - продуцентов экономически важных веществ разрабатываются методы создания коллекций и банков генов in vitro.
Основным источником генов являются семена. Для создания новых клеточных линий. синтезирующих ценные продукты, необходимо хранение коллекции клеток, то есть эталонов клеток-продуцентов, обладающих определенными характеристиками. Для исследования физиологических и биохимических процессов в культивируемых клетках возникает необходимость длительного сохранения исходных стандартных линий клеток. Таким образом, для решения задач требуются методы хранения культуры клеток. Есть два подхода в решении данной проблемы: замедление роста клеток и хранение в замороженном состоянии, то есть криосохранение (от греч. kгyos - «мороз», «лед»). Задача состоит в том, чтобы изменить кинетику роста культуры и увеличить время между пересадками. Это позволило бы пересаживать культуры раз в 3-4 месяца, год и даже реже. В настоящее время замедление роста под влиянием факторов, ограничивающих рост, достигнуто лишь для культур побегов и растений-регенерантов.
Наиболее действенный путь замедления роста состоит в снижении температуры культивирования в сочетании с пониженным освещением. Выбор температуры определяется холодостойкостью вида растения. Так, для депонирования коллекций картофеля использовалась температура 10 оС, а яблони 1 оС. Рекомендуют для культур, нормально растущих при 20 – 25 оС, использовать 4-10 оС.
Рост растения можно также замедлить добавлением к питательной среде осмотиков - маннита и сорбита, повышением концентрации сахарозы или внесением в питательную среду веществ, тормозящих рост. В качестве последних были использованы гидразид малеиновой кислоты, 2,2-метилгидразид янтарной кислоты, хлорхолинхлорид, абсцизовая кислота. В крайне редких случаях для замедления роста используют снижение содержания кислорода - гипоксию. Условия гипоксии создают применяя смесь 90% азота и 10% кислорода. Иногда уменьшают концентрацию кислорода и одновременно снижают атмосферное давление. Во избежание истощения питательных веществ и обезвоживания объем агаризованной среды для медленно растущих культур увеличивают. Если используется жидкая питательная среда, ее время от времени доливают, поскольку она активнее испаряется.
2 Криосохранение - это глубокое замораживание и хранение при сверхнизких температурах, например при температуре жидкого азота (-196°С). Такая температура гарантирует стабильное сохранение генетических характеристик объектов практически в течение любого срока. Данный метод позволяет хранить самый разнообразный материал - от изолированных протопластов до зародышей и семян. В настоящее время глубокое замораживание клеток, тканей и органов получило широкое распространение в медицине и животноводстве. Иначе обстоит дело с растительным материалом. Главные трудности связаны со спецификой растительных клеток и с самим процессом глубокого замораживания. Растительные клетки, имеющие большие размеры, большие вакуоли и много воды, сильнее повреждаются при замораживании и последующем оттаивании. Повреждение клеток связано с образованием льда как внутри клеток, так и снаружи. Лед обычно образуется сначала во внешнем растворе вокруг клеток. Точка замерзания цитоплазмы минус 1 оС, но клетки остаются не замерзшими до -10-15 оC, так как до этого плазмалемма еще предотвращает проникновение внутрь кристаллов льда, растущих во внешнем растворе. Рост кристаллов льда внутри клетки разрушает ее мембраны.
Если температура снижается медленно, то клетка успевает потерять часть свободной воды, которая выходит из нее и замерзает на поверхности медленно растущих кристаллов во внешнем растворе. Очень быстрое замораживание не сопровождается дегидратацией и приводит к возникновению кристаллов льда в цитоплазме. Медленное замораживание может полностью исключить кристаллизацию воды в клетке, но при этом неизбежно происходит значительная дегидратация и сжатие протоплазмы. Обезвоживание клетки происходит вследствие концентрирования внешнего раствора из-за образования в нем льда. Чрезмерный плазмолиз и вызванный им осмотический стресс (особенно при последующем деплазмолизе) приводит клетку к гибели.
Таким образом, причиной гибели клеток при замораживании является образование льда внутри клетки и механическое повреждение ее мембран, а также осмотический стресс, обусловленный сильным обезвоживанием клетки. Следовательно, все приемы, используемые в криосохранении, направлены на определенную сбалансированность обоих повреждающих факторов. Выживание клеток растений зависит от целого ряда условий: генетических и морфофизиологических их особенностей и способности к холодовому закаливанию, состава и количества природных или искусственно добавляемых криопротекторов, уровня проницаемости этих веществ и воды, скорости снижения температуры и условий оттаивания.
Работа по криосохранению культуры клеток состоит из следующих этапов (рис.18): - подготовка культуры клеток,
- добавление криопротектора,
- программное замораживание,
- хранение в жидком азоте,
- быстрое оттаивание,
- удаление криопротектора,
- рекультивирование и регенерация растений.
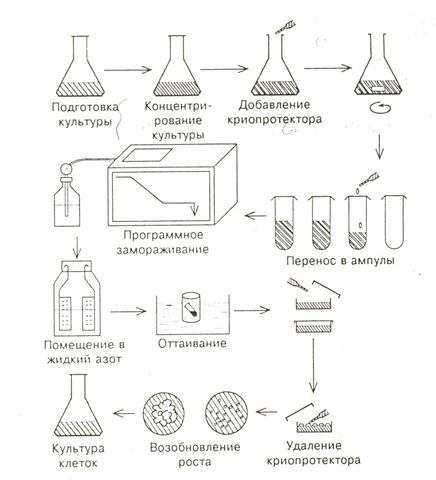
Рис.18. Этапы криосохранения культуры клеток
2.1 Остановимся на основных этапах криосохранения клеток. Экспериментально показана возможность хранения при сверхнизких температурах культивируемых клеток, изолированных меристем, кончиков побегов, зародышей, пыльцы. Однако для криосохранения столь различающихся между собой объектов, конечно, требуются различные подходы и условия начиная с самого начального этапа работы. Лучше всего методы криосохранения разработаны для суспензионных культур. Мелкие меристемоидные клетки более устойчивы к замораживанию, чем крупные вакуолизированные клетки. То же касается мелкодисперсных суспензий с рыхлыми агрегатами клеток по сравнению с большими плотными массами клеток. Клетки тропических видов растений могут оказаться менее устойчивыми, чем клетки растений умеренной зоны. Для более сложно организованных структур, таких, как меристемы, зародыши, эмбриоиды, требуется оптимизация условий каждого этапа. Особое значение имеет специальная подготовка культуры, целью которой является обогащение ее клетками меристематического типа. Длительное культивирование в осмотике, синхронизация деления клеток, сокращение сроков пересадки способствуют уменьшению размеров клетки и увеличивают их выживаемость. На отдельные культуры положительное влияние на жизнеспособность клеток оказывает пред
варительное культивирование с некоторыми аминокислотами, благодаря увеличению уровня эндогенных сахаров в клетках. Для суспензионных культур важным моментом подготовки является концентрирование.
2.2 Криопротекторы - это вещества, которые снижают точку замерзания, связывают внутриклеточную воду и защищают клетки от механического и осмотического стресса. К ним относятся диметилсульфоксид (ДМСО), глицерин, пролин и сахароза, которая является для растений естественным криопротектором. Сами криопротекторы тоже могут вызвать осмотический стресс, поэтому подбираются их оптимальные концентрации и сочетания.
ДМСО обладает уникальной проникающей способностью, это особенно важно для крупных плотных организованных структур, например меристем. Для них этап подготовки заключается, главным образом, в предварительном культивировании с добавлением в среду 5% ДМСО. Это обеспечивает создание эффективных криозащитных концентраций по всему апексу, размер которого около 0,3-0,5 мм.
Наряду с выбором криопротекторов, причем именно для данных клеток, очень важно найти оптимальную программу замораживания. Различают медленное постепенное замораживание, быстрое и сверхбыстрое. При медленном постепенном замораживании температура в интервале от 0 о до - 40о снижается со скоростью 0,5-1 о в мин. При быстром замораживании объект в ампуле с криопротектором погружается сразу в жидкий азот. При сверхбыстром замораживании сам объект непосредственно вводится в жидкий азот. Пыльцу можно замораживать в сухом виде, запечатанную в специальные пластмассовые ампулы, погружая их в жидкий азот. Данные, полученные криобанком ИФР в Москве: показывают, что бо лее успешные результаты дает программированное замораживание. Для этого требуются специальные конструкции с рабочей камерой, охлаждаемой с запрограммированной скоростью введением паров жидкого азота.
2.3 Оттаивание и восстановление роста культур - ответственные и часто критические этапы процесса. При слишком медленном оттаивании клеток в них происходит повторное образование льда, оказывающее повреждающее действие. Быстрое оттаивание предотвращает это. Оттаивание производят погружая ампулы в теплую баню (+40 оС) либо капая на замороженные объекты теплую воду или среду для культивирования. Однако в исключительных случаях более целесообразным оказывается медленное оттаивание.
После оттаивания удаляется криопротектор, что обычно делается на холоде. Основная часть физических изменений в клетках происходит при замораживании и оттаивании, однако только что оттаявшие клетки сильно предрасположены к дальнейшим повреждениям и поэтому требуют тщательного «выхаживания». Это начинается с прямого пересаживания клеток на восстанавливающую среду без промывки с сохранением в клетках криопротекторов. Часто криопротектор удаляется специальными условиями отмывки.
2.4 Состояние культур оценить очень сложно, когда материал находится на криосохранении. Оценка проводится после оттаивания и нужна для использования культур. Для быстрой оценки культур наиболее пригодны тесты на
жизнеспособность. Тесты желательно проводить не сразу после оттаивания, а на следующий день. Тесты проводят периодически в процессе возобновления роста для контроля за увеличением содержания жизнеспособных клеток или живой ткани.
Для образцов, видимых под микроскопом в проходящем свете, т. е, клеточных суспензий, протопластов, небольших каллусных и организованных структур, используют окрашивание флуоресцеиндиацетатом, феносафранином. Для каллусов и плотных крупных организованных структур используют соли тетразолия.
Количественной оценкой выживания является рост. Изучают рост культивируемых клеток используя любые стандартные методы измерения роста, включая прирост сырой и сухой массы, объем осевших клеток, оптическую плотность клеток, прямое микроскопическое наблюдение. Стандартные цитологические методы позволяют оценить степень повреждений и восстановительных процесса в, происходящих в тканях. Еще более точные данные получают при исследовании ультраструктуры в электронном микроскопе.
Учитывая гетерогенность культур клеток, их подготовку к замораживанию, нельзя полностью исключить возможность проявления селективных преимуществ для какой-нибудь субпопуляции, в особенности при низкой выживаемости после оттаивания. Поэтому бывает нужна генетическая, физиологическая и биохимическая проверка.
На этапе рекультивирования иногда применяют известные приемы интенсификации роста клеток во избежание селекции возможных мутантных холодоустойчивых клеток. Установлено, что хранение в жидком азоте не влияет на выживание и возобновление клеточных культур. Рекультивированные после хранения в жидком азоте клеточные культуры идентичны исходным и пригодны для биотехнологического применения.
Таким образом, криобанк клеток, меристем, пыльцы обеспечивает сохранение генофонда не только культивируемых in vitro штаммов-продуцентов, но и редких и исчезающих видов, что особенно важно для вегетативно размножаемых растений.
Контрольные вопросы:
1. Способы сохранения генофонда in vitro.
2. В чем преимущество криосохранения клеток?
3. Что такое криопротектор?
4. Подготовка клетки к криосохранению.
5. Как осуществляют замораживание и оттаивание клеток?
Список использованной литературы
1. Валиханова Г.Ж. Биотехнология растений. –Алматы: Конжык, 1996.- 272 с.
2.Андреева А. Биотехнология. –Караганда, 2000.
3. Приходько Н.А., Зимина В.Н. Биотехнология микроорганизмов.-Шымкент, 2006.-204 с.
4. Мухаметжанов С.К., Валиханова Г.Ж., Ережепов А.Е. Методическое руководство к лабораторным занятиям по культуре тканей и биотехнологии растений.-Шымкент, 2007.-108 с.
5. Калинин Ф.Л., Сарнацкая В.В., Полищук В.В. Методы культуры
тканей и клеток в физиологии и биохимии растений. –Киев: Наукова Думка,
1980.
6.Валиханова Г.Ж., Рахимбаев И.Р., Каржасова А.В., Бишимбаева Н.К.
Методическое руководство к практическим занятиям по культуре тканей
растений. -Алма-Ата: КазГУ, 1983.
7.Катаева П.В., Бутенко Р.Г. Клональное микроразмножение растений.-
М.: Наука, 1983.
8.Глеба Ю.Ю., Сытин к К.М. Клеточная инженерия растений. -Киев:
Наукова думка, 1984.
9.Бутенко Р.Г. Культура клеток растений и биотехнология. -М: Наука,
1986.
10. Клеточная инженерия / Бутенко Р.Г., Гусев MB., Киркин А.Ф.
Биортехнология, Т. 3. -М.; Высшая школа, 1987.
11. Биотехнология растений: культура клеток. - М;
Агропромиздат, 1989.
12.Муромцев Г.С, Бутенко Р.Г.. Тихоненко Г.И., Порофьев М.И.
Основы сельскохозяйственной биотехнологии. -М.; Агропромиздат, 1990.
13. Лабораторно-практические занятия по сельскохозяйственной
биотехнологии: Методические указания / Г.М. Артамонова, СИ. Герасимова,
СВ. Дегтярев, Е.З. Кочиева, Д.В. Калашников, И.К. Блиновский, Л.И.
Хрусталсва. Под ред. акад. ВАСХНИЛ B.C. Шевелухи.- М.: МСХА, 1991.
14. Калинин Ф.Л., Кушнир Г.П., Сарнацкая В.В. Технология
микроклонального размножения растений. -Киев: Наукова думка, 1992.
15. Heslop-Hamson J., Dodds J.H., Roberts L.W. Experiments in Plant
Tissue Culture. Cambridge University Press, 1995.
16. Gamborg O.L., Phillips G.C Plant Cell, Tissue and Organ Culture.
Springer- Veiiag 1995.
17. Smith R.H. Plant Tissue Culture: Techniques and Experiments.
Academic Press, 2000.
18. Основы сельскохозяйственной биотехнологии. -М.; Агропромиздат. 1990.-384 с.
Мамырбекова Айгуль Кумекбаевна, Абубакирова Ажар Абдугаппаровна
Биотехнология растений
Редактор
Подписано в печать
Формат бумаги XxY 1/16
Бумага типографская. Печать офсетная. Объем …п.л.
Тираж ….экз. Заказ № …*
© Издание Южно-Казахстанского государственного университета
им. М.Ауезова
Издательский центр ЮКГУ им. М.Ауезова, г. Шымкент, пр. Тауке хана, 5
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 8321; Нарушение авторских прав?; Мы поможем в написании вашей работы!