
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон Мозли
|
|
|
|
Рентгеновские лучи были открыты в 1895 г. и интенсивно изучались в последующие годы, началось их использование для экспериментальных целей: они незаменимы для определения внутренней структуры кристаллов, порядковых номеров химических элементов. Г. Мозли удалось измерить заряд атомного ядра с помощью рентгеновских лучей. Именно в заряде ядра заключается основное различие между атомными ядрами разных элементов. Г. Мозли назвал заряд ядра порядковым номером элемента. Единичные положительные заряды позднее назвали протонами (11р).
|
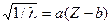 , где l - длина волны максимального пика в спектре рентгеновских лучей; а и b – константы, одинаковые для аналогичных линий данной серии рентгеновского излучения.
, где l - длина волны максимального пика в спектре рентгеновских лучей; а и b – константы, одинаковые для аналогичных линий данной серии рентгеновского излучения.
Порядковый номер (Z) – это число протонов в ядре. Но только к 1920 г. было установлено название «протон» и изучены его свойства. Заряд протона равен по величине и противоположен по знаку заряду электрона, то есть 1,602×10-19 Кл, а условно (+1), масса протона равна 1,67×10-27 кг, что приблизительно в 1836 раз больше, чем масса электрона. Таким образом, масса атома водорода, состоящего из одного электрона и одного протона, практически совпадает с массой протона, обозначают 11р.
Для всех элементов масса атома больше суммы масс электронов и протонов, входящих в их состав. Разница указанных величин возникает из-за наличия в атомах еще одного типа частиц, названных нейтронами (1оn), которые были открыты только в 1932 г. английским ученым Д. Чедвиком. Нейтроны почти равны по массе протонам, но лишены электрического заряда. Сумма числа протонов и нейтронов, содержащихся в ядре атома, называется массовым числом атома. Число протонов равно порядковому номеру элемента, число нейтронов равняется разности между массовым числом (атомной массой) и порядковым номером элемента. Ядра всех атомов данного элемента имеют одинаковый заряд, то есть содержат одинаковое число протонов, а число нейтронов может быть различно. Атомы, имеющие одинаковый заряд ядра, а значит и тождественные свойства, но разное число нейтронов, а, следовательно, разные массовые числа называются изотопами ( «изос» - равный, «топос» - место ). Каждый изотоп характеризуется двумя величинами: массовым числом (проставляется вверху слева от химического знака элемента) и порядковым номером (проставляется внизу слева от химического знака элемента). Например, изотоп углерода с массовым числом 12 записывается так: 126С или 12С, или словами: «углерод-12». Изотопы известны для всех химических элементов. Так, кислород имеет изотопы с массовыми числами 16, 17, 18: 168О, 178О, 188О. Изотопы калия: 3919К, 4019К, 4119К. Именно наличием изотопов объясняют те перестановки, которые в свое время сделал Д.И. Менделеев. Заметьте, что он сделал это только на основании свойств веществ, так как строение атомов ещё не было известно. Современная наука подтвердила правоту великого русского учёного. Так, природный калий образован в основном атомами его лёгких изотопов, а аргон – тяжёлых. Поэтому относительная атомная масса калия меньше, чем аргона, хотя порядковый номер (заряд ядра атома) калия больше.
Атомная масса элемента равна среднему значению из всех его природных изотопов с учётом их распространенности. Так, например, природный хлор состоит из 75,4 % изотопа с массовым числом 35 и 24,6 % изотопа с массовым числом 37; средняя атомная масса хлора 35,453. Атомные массы элементов, приводимые в периодической системе
Д.И. Менделеева, есть средние массовые числа природных смесей изотопов. Эта одна из причин, почему они отличаются от целочисленных значений.
Стабильные и неустойчивые изотопы. Все изотопы подразделяются на: стабильные и радиоактивные. Стабильные изотопы не подвергаются радиоактивному распаду, поэтому они и сохраняются в природных условиях. Примерами стабильных изотопов являются 16О, 12С, 19F. Большинство природных элементов состоят из смеси двух или большего числа стабильных изотопов. Из всех элементов наибольшее число стабильных изотопов имеет олово (10 изотопов). В редких случаях, например, у алюминия или фтора, в природе встречается только один стабильный изотоп, а остальные изотопы неустойчивы.
Радиоактивные изотопы подразделяются, в свою очередь, на естественные и искусственные и те и другие самопроизвольно распадаются, испуская при этом α- или β-частицы до тех пор, пока не образуется стабильный изотоп. Химические свойства всех изотопов в основном одинаковы.
Изотопы широко используют в медицине и научных исследованиях. Ионизирующее излучение способно разрушать живые ткани. Ткани злокачественных опухолей более чувствительны к облучению, чем здоровые ткани. Это позволяет лечить раковые заболевания при помощи γ-излучения (радиационная терапия), которое получают обычно с помощью радиоактивного изотопа кобальта-60. Излучение направляют на пораженный опухолью участок тела больного, сеанс лечения длится обычно несколько минут и повторяется в течение нескольких недель. Во время сеанса все остальные части тела больного должны быть тщательно закрыты непроницаемым для излучения материалом, чтобы предотвратить разрушение здоровых тканей.
В методе меченых атомов радиоактивные изотопы используют для того, чтобы проследить «маршрут» некоторого элемента в организме. Так, пациенту с больной щитовидной железой вводят препарат радиоактивного йода-131, что позволяет врачу проследить за прохождением йода по организму больного. Поскольку период полураспада
йода-131 всего 8 дней, то его радиоактивность быстро уменьшается.
Особенно интересно применение радиоактивного углерода-14 для определения возраста предметов органического происхождения на основе радиоуглеродного метода (геохронология) разработанный американским физико-химиком У. Либби. Этот метод удостоен Нобелевской премии в 1960 г. При разработке своего метода У. Либби использовал известный факт образования радиоактивного изотопа углерода-14 (в форме оксида углерода(IV)) в верхних слоях земной атмосферы при бомбардировке атомов азота нейтронами, входящими в состав космических лучей
147N + 10n → 146C + 11p
Радиоактивный углерод-14 в свою очередь распадается, испуская β-частицы и превращаясь снова в азот
146С → 147N + 0-1β
Атомы разных элементов, имеющие одинаковые массовые числа (атомные массы) называются изобарами. В периодической системе с уществует 59 пар и 6 троек изобар. Например, 4018Ar 4019K 4020Ca.
Атомы разных элементов, имеющие одинаковое число нейтронов, называются изотонами. Например, 136Ba и 138Xe – у них по 82 нейтрона в ядре атома.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1599; Нарушение авторских прав?; Мы поможем в написании вашей работы!