КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод валентных связей. Описать химическую связь – это значит определить энергию и длину связи.Но мы ничего не можем сказать ни о энергии
|
|
|
|
Описать химическую связь – это значит определить энергию и длину связи.Но мы ничего не можем сказать ни о энергии, ни о длине связи. Не поможет ли здесь квантовая химия?
Прежде всего, если уж уравнение Шредингера нельзя было решить для многоэлектронной одноцентровой задачи - атома, то конечно его нельзя решить для задачи, в которой два ядра и два электрона.
Одно из принятых приближений, позволяющих описать химическую связь - это теория валентных связей, впервые был использован немецкими учёными В.Гейтлером и Ф.Лондоном.
Ее суть состоит в том, что каждая связь рассматривается как состоящая из двух электронов и для каждого имеется атомная электронная функция j.
Из двух таких функций мы составляем общую функцию путем их перемножения:
что означает, что первый электрон находится на атоме а, а 2-й на атоме b. Но если они общие, то могут поменяться местами:
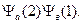
Теперь напишем общую функцию в виде
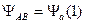
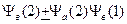
и подставив ее в уравнение Шредингера, посмотрим, что получится.
Получается неплохо. Если взяли знак +, что по принципу Паули означает, что спины антипараллельны ¯, получаем потенциальную кривую (пунктир) с минимумом, как и нужно для связи, а само электронное облако выглядит как на рис а).
Если же знак “-“, то кривая потенциальной энергии лишена минимума, спины параллельны, а электронное облако выглядит как на рис.б).
Метод В.С. базируется на следующих основных положениях:
: а) химическая связь между двумя атомами возникает как результат перекрывания АО с образованием электронных пар. (обобществление двух электронов);
б) атомы, вступающие в химическую связь, обмениваются между собой электронами, которые образуют связывающие пары. Энергия обмена электронами между атомами вносит основной вклад в энергию химической связи. Дополнительный вклад в энергию связи дают кулоновские силы взаимодействия частиц;
в) в соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с анипараллельными спинами;
г) характеристики химической связи (энергия, длина и др.) определяются типом перекрывания АО.
Если ковалентная связь образована одинаковыми атомами (Н-Н; О=О; CL-CL), то такая связь называется ковалентной неполярной связью. Если же один из атомов сильнее притягивает электроны, то электронная пара смещается в сторону этого атома – возникает полярная ковалентная связь. Критерием способности атома притягивать электрон служит электроотрицательность.
В следствии смещения электронной пары к одному из ядер повышается плотность отрицательного заряда у одного атома, а у другого положительная плотность, соответственно получают эффективный заряд 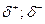 , - возникает диполь, представляющий собой электрически нейтральную систему с двумя одинаковыми по величине положительными и отрицательными зарядами, находящимися на одинаковом расстоянии друг от друга.
, - возникает диполь, представляющий собой электрически нейтральную систему с двумя одинаковыми по величине положительными и отрицательными зарядами, находящимися на одинаковом расстоянии друг от друга. 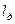 .
.
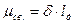 [
[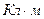 ] (кулон на метр)
] (кулон на метр)
Молекулы могут быть полярными и неполярными. Полярность молекулы характеризуется значением электрического момента диполя 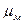 , который равен векторной сумме электрических моментов диполей связей, имеющихся в молекуле. Если связь неполярна, то и молекула неполярна. В многоатомных молекулах – сложнее зависимость
, который равен векторной сумме электрических моментов диполей связей, имеющихся в молекуле. Если связь неполярна, то и молекула неполярна. В многоатомных молекулах – сложнее зависимость 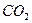 неполярная, хотя связи полярные: О
неполярная, хотя связи полярные: О С
С О происходит компенсация диполей.
О происходит компенсация диполей.
|
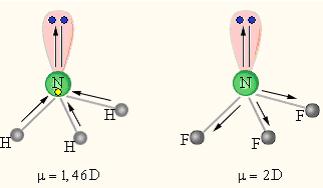
| Рисунок 5.3 - Сложение дипольных элементов в молекулах NH3 и NF3 |
Преимущества теории ВС
1) преимущество данной теории - мы получили как бы полное соответствие “валентная связь - электронная пара - валентный штрих.
Если же образуются двойные связи, то каждую также можно рассматривать в отдельности, но тогда уже перекрывание будет несколько другим. По типу перекрывания электронных облаков связи делятся на:
s -связи, когда область перекрывания находится на пряиой соединяющей ядра (s-s; s-p; p-p; s-d; p-d; d-d)
p -cвязи, область перекрывания по обе стороны от этой прямой. (p-p; p-d; d-d)
d -связи, образуют только d-орбитали
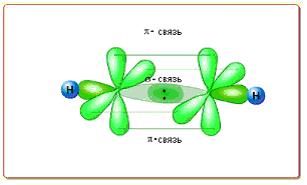
|
| Русунок 5.4 - Модель сигма- и пи-связи |
2) преимущество теории. Она объясняет направленность ковалентной химической связи.
Метод валентных связей иначе называют теорией локализованных электронных пар, поскольку в основе метода лежит предположение, что химическая связь между двумя атомами осуществляется с помощью одной или нескольких электронных пар, которые локализованы преимущественно между ними
Гибридизация была введена для объяснения того факта, что двухэлектронные двухцентровые химические связи, образованные за счет АО в разных энергетических состояниях, имеют одинаковую энергию. Так, Be*(2s11p1), B*(2s12p2), C*(2s12p3) образуют за счет s- и p-орбиталей соответственно две, три и четыре связи, а потому одна из них должна быть прочнее других. Однако опыт показывает, что в BeH2, BCl3, CH4 все связи равноценны. У BeH2 угол связи равен 180°, у BCl3 – 120°, а у CH4 – 109°28'.
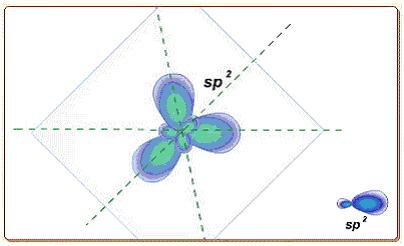
|
| Рисунок 5.5 - Модель гибридизация орбиталей. |
Согласно представлению о гибридизации, химические связи образуются смешанными – гибридными орбиталями (ГО), которые представляют собой линейную комбинацию АО данного атома (s- и p-АО Be, B, C), обладают одинаковыми энергией и формой, определенной ориентацией в пространстве (симметрией). Так s- и p-орбитали дают две sp-ГО, расположенные под углом 180° друг относительно друга.
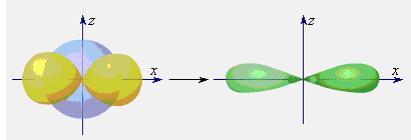
|
| Рисунок 5.6 - s-орбиталь + p-орбиталь и две sp-ГО. |
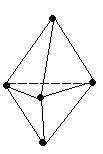
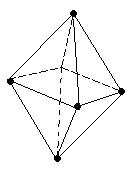
В молекуле CH4 гибридные орбитали из четырех АО углерода (одной s и трех p), называются sp3-орбиталями, они полностью эквивалентны энергетически и пространственно направлены к вершинам тетраэдра.
Таким образом, когда один атом образует несколько связей, а его валентные электроны принадлежат разным орбиталям ( s и p; s, p и d ), для объяснения геометрии молекул в МВС необходимо привлекать теорию гибридизации атомных орбиталей. Основные положения теории следующие:
- Введение гибридных орбиталей служит для описания направленных локализованных связей. Гибридные орбитали обеспечивают максимальное перекрывание АО в направлении локализованных σ-связей.
- Число гибридных орбиталей равно числу АО, участвующих в гибридизации.
- Гибридизуются близкие по энергии валентные АО независимо от того, заполнены они в атоме полностью, наполовину или пусты.
- В гибридизации участвуют АО, имеющие общие признаки симметрии.
Согласно табл. 3.3 гибридные орбитали дают молекулы с углами 180°, 120°, 109°28', 90°. Это правильные геометрические фигуры. Такие молекулы образуются, когда все периферические атомы в многоэлектронной молекуле (или ионе) одинаковы и их число совпадает с числом гибридных орбиталей. Однако, если число гибридных орбиталей больше числа связанных атомов, то часть гибридных орбиталей заселена электронными парами, не участвующими в образовании связи, – несвязывающими или неподеленными электронными парами.
Таблица 5.1 - Гибридные орбиталей и геометрия молекул
| ||||||||||||||||||||||||||||||
Число связей между атомами в методе ВС называется кратностью связи. Пи-связи в молекулах или ионах, у которых возможно несколько способов локализации связей между атомами, называются делокализованными связями:
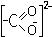
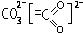
Теория валентных связей наглядна, описывает геометрию молекул, но не лишена недостатков - она не может объяснить:
1) Парамагнетизм молекулы О2 (наличие у нее неспаренных электронов). Вещества, имеющие неспаренные электроны, парамагнитны, т.е. втягиваются в магнитное поле. Вещества, не имеющие неспаренных электронов, диамагнитны, т.е. вытягиваются из магнитного поля.
2) Существование электрононедостаточных молекул - Н2+ , 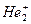
3) Существование электроноизбыточных молекул - 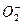 , соединений инертных газов.
, соединений инертных газов.
4) Существование радикалов.
Действительно, существует молекула Н2 - r0=0.74 A, E=432 кДж/моль; но у нее можно отнять 1 электрон и получим Н2+ r0=1.08 A, E= 265 кДж/моль
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 786; Нарушение авторских прав?; Мы поможем в написании вашей работы!