
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод молекулярных орбиталей. В методе МО молекула рассматривается как единая система
|
|
|
|
В методе МО молекула рассматривается как единая система. Полагают, что все электроны движутся в поле всех ядер, составляющих молекулу по неким молекулярным орбиталям.
Сначала строим орбитали, забыв про существование электронов, потом рассаживаем по ним электроны.
Как строим орбитали? Приближение ЛКАО – МО линейная комбинация атомных орбиталей (проще говоря их алгебраическая сумма с разными коэффициентами).- - образуется молекулярная орбиталь.

|
| Рисунок 5.7 - Энергетическая диаграмма атомных и молекулярных уровней водорода. |

 волновая функция электрона в молекуле
волновая функция электрона в молекуле
а, в – коэфициенты, учитывающие долю каждой АО в образовании МО.
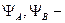 волновые функции электронов АО соответственно в атомах А и В.
волновые функции электронов АО соответственно в атомах А и В.
Рассмотрим молекулярный ион Н2+
Правило:- сколько взяли атомных орбиталей, столько получаем молекулярных.
Подставив в уравнение Шредингера выражение, получим два уровня энергии: один ниже, другой выше исходных. Подставив в уравнение Шредингера выражение, получим два уровня энергии: один ниже, другой выше исходных. Ниже – связывающие орбитали sсв, , т.к. электрон, на нее попадающий, дает выигрыш в энергии, выше разрыхляющая орбиталь - s*.
Единственный электрон молекулярного иона Н2+ заполняет связывающую орбиталь и получаем химическую связь, пусть не очень прочную.
Молекулярные орбитали, получающиеся при комбинации
S-AO, называются 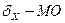 ;
;
при комбинации  ;
;
при комбинации  и
и и
и  ;
;
при комбинации некоторых р и d-АО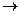 ;
; 
при комбинации d-АО образуются  -МО.
-МО.
В молекуле Н2 два электрона, по принципу Паули они оба заполняют sсв орбиталь.
Тогда мы будем иметь электронную пару как и в методе ВС.
Порядок связи n определяется в методе МО:
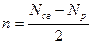
равен половине разности числа электронов на связывающих  и разрыхляющих
и разрыхляющих  МО.
МО.
H2+ (s1s)1 n=1/2
H2 (s1s)2 n=1
но! He2+ (s1s)2 (s*1s)1 n=1/2 - может существовать,
в то время как He2 (s1s)2 (s*1s)2 n=0 - не может существовать.
Таблица 5.2 - Энергия, длина и порядок связи в молекулах элементов 1 периода
| Молекулярные параметры | Молекулы и молекулярные ионы | |||
| МО | H2+ | H2 | He2+ | He2 |
| σ* | - | - | 
| 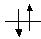
|
| σсв | 
| 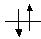
| 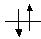
| 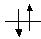
|
| Eсв, кДж∙моль–1 | ||||
| Длина связи, r 0, нм | 0,106 | 0,075 | 0,108 | – |
| Порядок связи | 0,5 | 0,5 |
Двухатомные молекулы элементов 2 периода
Для двухатомных молекул Li2 - Ne2 атомным базисом, т.е. теми орбиталями, которые могут принимать участие в связи будут валентные 2s и три 2p орбитали от каждого атома. Воспользуемся некоторыми правилами создания молекулярных орбиталей.
1. Из n атомных орбиталей должны получить n молекулярных орбиталей.
2. Связывающие и разрыхляющие орбитали получаются в результате перекрывания атомных орбиталей.
3. Перекрывание определяется геометрией атомных орбиталей
4. Перекрываются орбитали, близкие по энергии.
5. При заполнении электронов орбиталей будем руководствоваться принципами минимума энергии, Паули и правилом Хунда.
Из рисунка видно, что перекрываются прежде всего s - s и px - px. Но поскольку s и p имеют разную энергию, то в первом приближении можно считать, что они и перекрываются только друг с другом. Тогда:
Теперь разберемся с py и pz. Очевидно, что они перекрываются только друг с другом и при этом по p типу. Это перекрывание меньше и орбитали меньше разъедутся по энергии. Также очевидно,, что мы получим одинаковые по энергии орбитали
| 1) y1= s1+s2 | s2s |
| 2) y2= s1 - s2 | s*2s |
| 3) y3= px1 - px2 | s2рх (см. знаки ф-й) |
| 4) y4= px1+px2 | s*2рх |
| 5) y5=py1+py2 | p2ру | 7) y7=pz1+pz2 | p2pz |
| 6) y6= py1 - py2 | 2p*ру | 8) y8=pz1 - pz2 | p*2pz |
Получили 8 орбиталей как и требовалось. Но мы сделали одно предположение, которое может оказаться слишком нестрогим: рассматривали отдельно перекрывание s и px орбиталей. В конце периода, действительно эти атомные орбитали сильно разнятся по энергии и это предположение оправдано. Но в начале они близки по энергии и их надо рассматривать все вместе, что приводит к некоторому нарушению порядка МО - s2px связывающая и разрыхляющая орбитали под “давлением” s2s как бы поднимаются вверх и s2px оказывается выше p2py. См. рис. Вот теперь можно рассмотреть конкретно каждую молекулу

Рисунок 5.8 - Энергетическая диаграмма атомных и молекулярных уровней
двухатомных молекул второго периода (начало периода)
Li2 (2s1)® 2эл. (s2s)2 n=1 (действительно, в паре есть такие молекулы)
Вe2 (2s2)®4эл. (s2s)2 (s*2s)2 n=0,
нет молекулы Be2
B2 (2s22p1) ®6эл. (s2s)2 (s*2s)2 (p2py)2 n=1, (вот где пригодилась вторая схема - B2 в паре имеет 2 неспаренных электрона.
. С2 (2s22p2) ®8эл.(s2s)2(s*2s)2(p2py)2(П2pz)2 n=2
N2(2s22p3)®10эл.(s2s)2(s*2s)2(p2py)2(П2pz)2(s2px)2 n=3, заняты все связывающие орбитали, самая прчная тройная связь

|
| Рисунок 5.9 - Уровни энергии МО элементов 2 периода (конец периода). Заселение МО указано для О2 |
Переходим к первой схеме
О2 (2s22p4) ®12эл. (s2s)2(s*2s)2(s2px)2(П2py)2 (П2pz)2(П*2py)2 n=2, так вот откуда неспаренные электроны в молекуле кислорода!
F2(2s22p5)®14эл.(s2s)2(s*2s)2(s2px)2(П2py)2(П2pz)2 (П*2py)2(П*2pz)2 n=1
Ne2(2s22p6) ®16эл. (s2s)2(s*2s)2(s2px)2(П2py)2 (П2pz)2(П*2py)2(П*2pz)2(s*2px)2 n=0
Молекула Ne2 существовать не может. Но молекула NeF уже имеет право на существование, поскольку главное правило возможности существования молекул - количество электронов на связывающих орбиталях должно быть больше, чем на разрыхляющих.
Вывод: МО объяснила нам существование электронодефицитных молекул (H2+), парамагнетизм молекулы кислорода, возможность инертных газов вступать в химические связи. Она объясняет особую прочность молекулы СО: в этой молекуле как и в молекуле азота 10 электронов (4 от С и 6 от О, но в методе МО не важно чьими были электроны), следовательно, связь в ней тройная.
Недостатки МО
1) Она не наглядна.
2) Не дает геометрии молекул.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1991; Нарушение авторских прав?; Мы поможем в написании вашей работы!