
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комплексы
|
|
|
|
Аналогичным образом образуется соединение КРF6 при взаимодействии КF и РF5,которое можно записать в виде К[РF6]. При взаимодействии сульфата меди и аммиака образуется сложное соединение
CuSO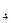 + 4NH
+ 4NH =CuSO
=CuSO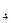 ∙ 4NH
∙ 4NH ,
,
которое выражается формулой [Cu(NH )
)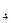 ] SO
] SO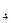 .
.
Сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму, получили название комплексных или координационных соединений.
Согласно координационной теории швейцарского ученого А.Вернера комплексные соединения состоят из двух сфер: внешней и внутренней.
В приведенных выше примерах внешними сферами являются К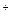 и SO
и SO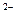
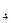 . Внутренняя сфера, называемая также комплексом, включает центральный ион или атом, вокруг которого координируются отрицательно заряженные ионы или нейтральные молекулы. При записи комплексного соединения внутреннюю сферу или комплекс заключают в скобки, например[Zn(CN)
. Внутренняя сфера, называемая также комплексом, включает центральный ион или атом, вокруг которого координируются отрицательно заряженные ионы или нейтральные молекулы. При записи комплексного соединения внутреннюю сферу или комплекс заключают в скобки, например[Zn(CN)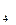 ]
]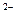 , [Zn(NH
, [Zn(NH )
)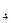 ]
] 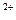 .
.
Центральный ион или атом называется комплексообразователем, а координируемые им ионы или молекулы- лиганидами. В приведенных выше примерах комплексообразователями являются ион фосфора в [PF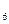 ]- и ион меди Cu
]- и ион меди Cu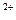 в [Cu(NH
в [Cu(NH )
)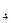 ]
]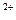 .Число монодентантных лиганидов, координируемых комплексообразовате- лем, называют координационным числом. В приведенных примерах координационное число равно соответственно 6 и 4.
.Число монодентантных лиганидов, координируемых комплексообразовате- лем, называют координационным числом. В приведенных примерах координационное число равно соответственно 6 и 4.
В зависимости от заряда различают анионные комплексы, например [PF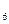 ]-,, [Zn(CN)
]-,, [Zn(CN)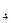 ]
]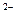 , [Al(OH)
, [Al(OH)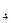 ]-, катионные комплексы, например [Cu(NH
]-, катионные комплексы, например [Cu(NH )
)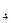 ]2+,[Ni(H
]2+,[Ni(H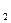 O)
O)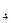 ]
]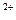 , и нейтральные комплексы, например [Ni(CO
, и нейтральные комплексы, например [Ni(CO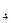 )] и [Pt(NH
)] и [Pt(NH )
)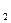 Cl
Cl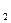 ]. Нейтральные комплексы не имеют внешней сферы. Заряд комплекса численно равен алгебраической сумме заряда центрального иона и зарядов лигандов.
]. Нейтральные комплексы не имеют внешней сферы. Заряд комплекса численно равен алгебраической сумме заряда центрального иона и зарядов лигандов.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 315; Нарушение авторских прав?; Мы поможем в написании вашей работы!