
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Газообразное состояние вещества
|
|
|
|
В газообразном состоянии молекулы находятся друг от друга на значительных расстояниях и соответственно занимают очень малую долю объёма. По этому при невысоких давлениях и температурах молекулы в газообразном состоянии практически не взаимодействуют друг с другом. Структура вещества в газообразном состоянии не- упорядочена.
Наиболее проста теория (и математическое описание) газового состояния. При "нормальных условиях" (0оС или 273,15 К и 1 атм. или 101325 Па) большинство газов вполне удовлетворительно описываются уравнением состояния идеального газа (уравнение Клапейрона -Менделеева):
pv = nRT (7.3)
где n – число молей газа;
R– молярная газовая постоянная, 8,314 Дж/к . моль.
Газ, который подчиняется этому закону, называется идеальным газом:
а) газ состоит из большого числа молекул, которые находятся в непрерывном движении;
б) молекулы газа занимают пренебрежительно малую долю объёма;
в) молекулы газа не притягиваются друг к другу;
г) время столкновения молекул друг с другом очень мало по сравнению со временем между столкновениями;
д) средняя кинетическая энергия газа пропорциональна абсолютной температуре.
Идеальный газ состоит из частиц (молекул), представляющих собой абсолютно твердые упругие шарики бесконечно малого размера, взаимодействием между которыми (кроме редких упругих столкновений) можно пренебречь.
Таблица 7.1 - Реальные мольные объемы некоторых газов при н.у.
| Водород | 22,428 л |
| Гелий | 22,424 л |
| Аммиак | 22,400 л |
| Азот | 22,408 л |
| Кислород | 22,392 л |
| Углекислый газ | 22,261 л |
| Хлороводород | 22,253 л |
Для реальных газов используют уравнения состояния с поправками, учитывающими собственный размер молекул и взаимодействие между ними. Во многих случаях достаточно приближенного уравнения Ван-дер-Ваальса:
(p+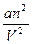 ) (V-nb)=nRT, (7.4)
) (V-nb)=nRT, (7.4)
где a/V2 – поправка, учитывающая взаимное притяжение молекул ("внутреннее давление");
b – поправка, учитывающая собственный объем молекул и их взаимное отталкивание.
На основании молекулярно-кинетической теории газов для идеальных газов. Среднеквадратичная скорость молекул определяется его молярной массой:
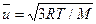 . (7.5)
. (7.5)
Однако, скорость отдельных молекул значительно различается. Распределение молекул по скоростям называется распределением Максвелла-Больцмана- оно зависит от t и типа газов:

Рисунок 7.1 – Распределение Максвелла-Больцмана
7.3 Плазма
При очень высоких температурах газ переходит в особое состояние, называемое плазмой. В общем случае плазма-это смесь беспрерывно перемещающихся атомов, электронов, положительных ионов и атомных ядер. Плазма с температурой 10-100 тыс. градусов называется «холодной», с температурой порядка миллиона градусов –«горячей». В последнем случае нейтральные атомы в плазме существовать не могут.
В земных условиях плазменное состояние реализуется в молниях и северном сиянии, электрической дуге, светящемся веществе неоновых и аргоновых ламп, пламени горелки. В состоянии плазмы находится основная масса космического вещества –звезды, туманность, межзвездное вещество.
Характерной особенностью плазмы является высокий энергетический уровень ее частиц, что позволяет проводить в плазме химические реакции, требующие подвода высоких энергий. Плазма подчиняется газовым законам. Основное ее отличие от обычных газов проявляется при воздействии магнитного и электрических полей, при котором в плазме возникает направленное движение молекул и электронов.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 574; Нарушение авторских прав?; Мы поможем в написании вашей работы!