
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термохимические расчеты
1. Закон Лавуазье-Лапласа: тепловой эффект обратной реакции равен тепловому эффекту прямой, но с обратным знаком.
2. Закон Гесса (1840): изменение энтальпии процесса зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути процесса.
Тепловой эффект есть функция состояния. Что это значит?
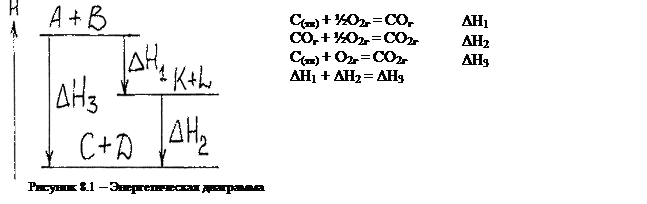 |
Рассмотрим энергетическую диаграмму.
Следствия из закона Гесса
1) Тепловой эффект кругового процесса равен нулю. Круговой процесс - система, выйдя из начального состояния, в него же и возвращается.
DН1 + DH2 - DH3 = 0
Отсюда же вытекает и закон Лавуазье-Лапласа.
2) Тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования начальных (исходных) веществ.
3) Тепловой эффект реакции равен сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания конечных продуктов.
Рассмотрим второе следствие из закона Гесса.
Поскольку абсолютное значение энтальпии H определить нельзя, а можно только определить ее изменение DH, т е. нет точки отсчета, договорились, считать за таковую состояние простых веществ, т.е. считать равными нулю теплоты образования простых веществ.
Простое вещество - форма существования химического элемента в том агрегатном состоянии и в той аллотропной модификации, которая наиболее устойчива при стандартных условиях.
Энтальпия образования - тепловой эффект образования моля вещества из простых веществ DHof.
DHof(KClO3) [K] + ½(Cl2) + 3/2(O2) = [KClO3].
Значение DHof может быть отрицательной DHof(HCl)=-92.3 кДж/моль, может быть положительной DHof(NO) = +90,2 кДж/моль.
Что нам дает второе следствие из закона Гесса? Можно рассчитать значение DH реакции, зная теплоты образования участвующих веществ.
CaO+SiO2=CaSiO3 DHo=DHof(CaSiO3) - DHof(CaO) DHof (SiO2),
Можно рассчитать неизвестную теплоту образования из измеренного DHo.
2B5H9 + 12O2=5B2O3 + 9H2O DHo = -9018 кДж Hof(B5H9)=?,
Кстати, борогидриды используются в ракетном топливе - огромный тепловой эффект.
DHo =5DHof(B2O3) + 9DHof(H2O) - 2DHof(B5H9).
Третье следствие из закона Гесса имеет значение для органической химии и биохимии.
Энтальпия сгорания - тепловой эффект сгорания 1 моля вещества до CO2 и H2O.
CH3COOH + C2H5OH = CH3COOC2H5 + H2O,
DHo = DHoс(СH3COOH) + DHoc(C2H5OH) - DHoc(CH3COOC2H5).
В технических расчетах используют удельную теплоту сгорания QT, которая равна количеству теплоты, выделяющейся при сгорании 1 килограмма жидкого или твердого топлива и 1 м3 газообразного вещества до образования высших оксидов.
Теплота образования из атомов - DHof(ат) - изменение энтальпии при образовании вещества из газообразных атомов. DHof(ат) всегда отрицательна, в отличие от стандартной теплоты образования. Это суммарная энергия химических связей в веществе. Как ее определить? Для этого используем 1 следствие из закона Гесса: DHoциклического процесса=0.
Ни один химический процесс не идет через образование свободных атомов, но поскольку изменение энтальпии DHo не зависит от пути процесса, ничто не мешает нам мысленно его провести через стадии образования свободных газообразных атомов.
Рассмотрим реакцию образования воды:
H2+1/2O2=H2O DHof = -285,85 кДж/моль.
 Нарисуем термодинамический цикл, где за ноль принято (H2)+1/2(O2). Теперь сначала разорвем молекулу водорода на атомы. Этому соответствует энтальпия 2DHof(H) или DHoат(Н2), затем разорвем также половину моля О2 - затратим DHof(О) или Ѕ DHoат(O2). А потом соединим 2(Н) + (О) и получим ту же воду.
Нарисуем термодинамический цикл, где за ноль принято (H2)+1/2(O2). Теперь сначала разорвем молекулу водорода на атомы. Этому соответствует энтальпия 2DHof(H) или DHoат(Н2), затем разорвем также половину моля О2 - затратим DHof(О) или Ѕ DHoат(O2). А потом соединим 2(Н) + (О) и получим ту же воду.
Поскольку все связи в молекуле воды одинаковы средняя энергия связи будет определяться как:
Есв= DHof(ат)/n. (8.5)
 Энергия кристаллической решетки - энергия, которую нужно затратить, чтобы разорвать связи в ионной кристаллической решетке и превратить ее в газообразные ионы. Опять пользуемся термодинамическим циклом, который называется циклом Борна-Габера. Теперь нам понадобится не только разорвать связи в исходных простых веществах, но и оторвать электрон у металла (I1) и присоединить его к электроотрицательному атому.
Энергия кристаллической решетки - энергия, которую нужно затратить, чтобы разорвать связи в ионной кристаллической решетке и превратить ее в газообразные ионы. Опять пользуемся термодинамическим циклом, который называется циклом Борна-Габера. Теперь нам понадобится не только разорвать связи в исходных простых веществах, но и оторвать электрон у металла (I1) и присоединить его к электроотрицательному атому.
1) DН°f(Na)=108,9 кДж/моль атомизация кристаллического натрия Na(k)=Na(i),
2) ионизация атомов натрия DН°f(Cl)= 496кДж/моль Na(г)-e-Na+(г),
3) диссоциация молекул хлора1/2Cl®Cl(г) DН°д=121 кДж/моль,
4) присоединение электронов к атомам хлора Cl(г)+e-Cl-(г) DНср.э=360 кДж/моль,
5) взаимодействие ионов Na+(г)+ Cl-(г) =NaCl DН°f (NaCl),
6) U – энергия кристаллической решетки.
Значение DH зависит от температуры, но слабо, и в первом приближении этой зависимостью можно пренебречь:
C + 1/2O2=CO DН(500oC)=-174 кДж, DН(1500оС)=-165 кДж,
а точность измерения DН обычно не более 2 кДж. То же самое можно сказать о зависимости DН от давления:
1/2Ѕ(N2)+3/2(H2)=(NH3) DН(p=101кПа) отличается от DН(p=50500кПа) только на 5%.
|
|
Дата добавления: 2014-01-04; Просмотров: 655; Нарушение авторских прав?; Мы поможем в написании вашей работы!