
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическое равновесие в гетерогенных системах
|
|
|
|
Способы смещения равновесия
Принцип Ле-Шателье: если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяются концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет это воздействие
1. Влияние концентраций компонентов системы.
СН4 + 2Н2О(г) = СО2 + 4Н2 ,
Если в систему добавить метан, то равновесие нарушается, ускорится прямая реакция, что приведет к увеличению СО2 и Н2 и уменьшению Н2О, то есть равновесие смещается вправо. Процесс будет протекать до тех пор, пока не установится новое равновесие. Новое равновесие концентраций будут такими, чтобы соотношения между ними, определяемое константой равновесия, оставалось постоянным. Если в систему ввести дополнительное количество СО2, то в соответствии с принципом Ле Шателье равновесие сместится влево.
2. Влияние общего давления в системе. Если в результате реакции изменяется число молей газообразных веществ, то изменение общего давления в системе вызывает смещение равновесия. В соответствии с принципом Ле Шателье увеличение общего давления в системе вызывает смещение равновесия в сторону уменьшения числа молей газообразных веществ, то есть в сторону уменьшения давления. Для данной реакции – смещение влево (слева Sni=3, справа Sni=5).
3. Влияние температуры. С увеличением температуры равновесие смещается в сторону эндотермической реакции, то есть реакций, протекающих с поглощением теплоты. Для рассматриваемой реакции равновесие смещается в правую сторону (DН>0), а для экзотермической реакции
2Н2 + О2 = 2Н2О,
(DН<0) – в левую сторону.
4) катализаторы не влияют на положение равновесия.
Из вышесказанного ясно, что равновесие можно сдвигать, изменяя условия. Чтобы качественно определить, в какую сторону оно сместится, можно воспользоваться принципом Ле Шателье: если на систему, находящуюся в равновесии оказывается внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет внешнее воздействие.
Химические реакции, протекающие на границе раздела фаз, называются гетерогенными химическими реакциями. Если скорости прямой и обратной гетерогенных реакций равны, то наступает гетерогенное химическое равновесие:
 С(к) + 2Н2О СО2 + 2Н2, (а)
С(к) + 2Н2О СО2 + 2Н2, (а)
 МО(к) + Н2 М(к) + Н2О, (б)
МО(к) + Н2 М(к) + Н2О, (б)
 СаСО3 СаО(к)+СО2. (в)
СаСО3 СаО(к)+СО2. (в)
Условие гетерогенного химического равновесия – равенство нулю изменения энергии Гиббса:
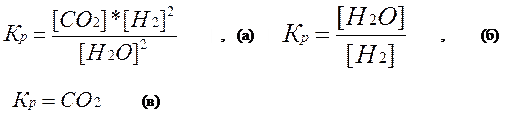 |
Константы гетерогенного химического равновесия, приведенных выше химических реакций:
|
 |
В уравнения констант гетерогенного химического равновесия не входят никакие члены, относящиеся к твердым веществам, участвующим в прямой и обратной реакциях.
Константа гетерогенного химического равновесия зависит от температуры, при повышении температуры:
 |
t
Твердые исходные вещества и продукты реакции не влияют на смещение гетерогенного химического равновесия.
9.4 Фазовое равновесие
Равновесие, при котором происходят процессы перехода вещества из одной фазы в другую без изменения химического состава, называется фазовым равновесием:
плавление
 Твердое вещество жидкость
Твердое вещество жидкость
кристаллизация
испарение
 Жидкость пар
Жидкость пар
конденсация
Условием фазового равновесия является равенство энергии Гиббса нулю DG=0.
Для фазового равновесия соблюдается принцип Ле Шателье.
Выбор параметров, влияющих на равновесие данной гетерогенной системы и условием равновесия определяется ПРАВИЛОМ ФАЗ. Это наиболее общий закон гетерогенного химического и фазового равновесия. Правило фаз Гиббса – Коновалова:
Число степеней свободы в гетерогенной системе равно числу компонентов, плюс число внешних условий и минус число фаз:
С = К + 2 — Ф, (9.8)
где С – число степеней свободы;
К – число компонентов;
Ф – число фаз.
Компонентом называется химически однородная составная часть вещества, которая может быть выделена из системы.
В случае фазового равновесия число независимых компонентов равно общему числу компонентов.
Например: смесь О2 и N2 – двухкомпонентная.
При протекании химических реакций число независимых компонентов равно общему числу компонентов за вычетом числа химических реакций, связывающих эти компоненты.
СО2+С=2СО к=3 – 1 = 2
Числом степеней свободы С называется число внешних условий, которые можно изменить в определенных пределах без изменения числа и вида фаз.
На фазовое равновесие влияют t, p, то n=2, тогда: С=к+2-Ф.
Фазовая диаграмма (диаграмма состояния) -диаграмма, по которой можно определить условия устойчивости фаз и фазового равновесия.

Для однокомпонентных систем:
С = 3 - Ф.
Однофазовые системы имеют две степени свободы и называются бивариантными.
Двухфазовые системы имеют одну степень свободы и называются моновариантной.
Трехфазовая система не имеет степеней свободы (С=0) и называются инвариантной.
Фазовая диаграмма воды (рисунок 10.2):
ОС – равновесие процесса кипения;
точка «С» - критическая точка; выше точки «С» - сверхкритическое состояние: низкая вязкость, высокая диффузионная активность.
ОВ – кривая плавления;
ОА – процесс сублимации;
ОД – метастабильное состояние (переохлаждение);
точка О – тройная точка, существует равновесие между тремя фазами.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 3336; Нарушение авторских прав?; Мы поможем в написании вашей работы!