
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры уравнений реакций гидролиза
|
|
|
|
I. Соль образована сильным основанием и сильной кислотой:
KNO3 + H2O ¹
K+ + NO3- + H2O ¹ нет гидролиза рН = 7.
II. Соль образована слабым основанием и сильной кислотой:
AlCl3 + H2O (AlOH)Cl2 + HCl
(AlOH)Cl2 + HCl
Al3+ + 3Cl- + H2O AlOH2+ + 2Cl- +H+ + 3Cl-
AlOH2+ + 2Cl- +H+ + 3Cl-
Al3+ H2O AlOH2+ + H+ pH < 7.
AlOH2+ + H+ pH < 7.
По второй ступени гидролиз идет незначительно, а по третьей ступени практически не идет.
III. Соль образована сильным основанием и слабой кислотой:
Na2CO3 + H2O NaHCO3 + NaOH
NaHCO3 + NaOH
2Na+ + CO32- + H2O  2Na+ + HCO3- + OH-
2Na+ + HCO3- + OH-
CO32- + H2O HCO3- + OH- pH > 7.
HCO3- + OH- pH > 7.
По второй ступени гидролиз практически не идет.
IV. Соль образована слабым основанием и слабой кислотой:
CH3COONH4 + H2O CH3COOH + NH4OH
CH3COOH + NH4OH
CH3COO- + NH4+ +H2O CH3COOH + NH4OH
CH3COOH + NH4OH
Для солей подобного типа рН вычисляется следующим способом:
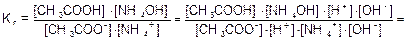
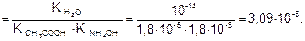
Идет частичный гидролиз, так как Кг << 1.
Степень гидролиза равна: h = 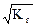 = 5,56´10-3.
= 5,56´10-3.
Концентрация ионов водорода равна: [H+] =  = 10-7M.
= 10-7M.
В ряде случаев, когда соль образована очень слабым основаниями и кислотами идет полный гидролиз.
Al2S3 + 6H2O ® 2Al(OH)3¯ + 3H2S
Возможность полного гидролиза следует учитывать в обменных реакциях.
Al(SO4)3 + 3Na2CO3 + 3H2O ® 2Al(OH)3¯ + 3Na2SO4 + 3CO2
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1923; Нарушение авторских прав?; Мы поможем в написании вашей работы!