
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Протолитическая теория кислот и основания
|
|
|
|
Причина диссоциации электролитов - их взаимодействие с водой. Вода образует при диссоциации катион водорода и анион гидроксила. Катион водорода - протон - имеет малый радиус
(»10-15 м) и в воде гидратирован - его обычное координационное число равно четырем. Формула гидрата протона - Н9О4+, но для простоты ее записывают как Н3О+. В растворах протоны переходят от одних соединений к другим.
HNO2 + H2O  H3O+ + NO2-
H3O+ + NO2-
кислота 1 основание 2 кислота 2 основание 1
Протолиз - процесс передачи протона.
Протолиты - кислоты и основания, отдающие и принимающие протоны.
Протолитическое равновесие - кислотно-основное равновесие - ионно-молекулярное равновесие, устанавливающееся после передачи протона. К протолитическим процессам относятся процессы диссоциации, ионные реакции в растворах, реакции гидролиза.
Кислота - молекула или ион, способная отдавать протон. Каждой кислоте соответствует сопряженное с нею основание. Сила кислот характеризуется константой кислоты Кк.
H2CO3 + H2O  H3O+ + HCO3- Kк = 4´10-7.
H3O+ + HCO3- Kк = 4´10-7.
NH4+ + 2H2O  NH3´H2O + H3O+ Kк = 6´10-10.
NH3´H2O + H3O+ Kк = 6´10-10.
[Al(H2O)6]3+ + H2O [Al(H2O)5OH]2+ + H3O+ Kк = 9´10-6.
[Al(H2O)5OH]2+ + H3O+ Kк = 9´10-6.
Основание - молекула или ион, способная принимать протон. Каждому основанию соответствует сопряженная с ним кислота. Сила оснований характеризуется константой основания Ко.
NH3´H2O (H2O) NH4+ + OH- Ко = 1,8´10-5.
NH4+ + OH- Ко = 1,8´10-5.
C5H5N + H2O C5H5NH+ + OH- Ко = 1,8´10-5.
C5H5NH+ + OH- Ко = 1,8´10-5.
Амфолиты - протолиты, способные к отдаче и к присоединению протона.
HCO3- + H2O  H3O+ + CO32- HCO3- - кислота
H3O+ + CO32- HCO3- - кислота
HCO3- + H2O  H2CO3 + OH- HCO3- - основание
H2CO3 + OH- HCO3- - основание
Для воды имеем: H2O+ H2O H3O+ + OH-
H3O+ + OH-
К(Н2О) = [H3O+][OH-] = 10-14 и pH = -lg[H3O+].
Константы Kк и Ко для сопряженных кислот и оснований связаны между собой.
HA + H2O  H3O+ + A- Kк =
H3O+ + A- Kк = 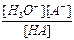
A- + H2O  HA + OH- Ко =
HA + OH- Ко = 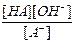
Отсюда Kк´Ко =  ´
´ = [H3O+]´[OH-] = К(Н2О)
= [H3O+]´[OH-] = К(Н2О)
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 435; Нарушение авторских прав?; Мы поможем в написании вашей работы!