
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства азота и его соединений
|
|
|
|
Химия элементов VA группы
Свойства соединений олова и свинца
Cвойства кремния и его соединений
Кремний можно получить по реакции:
SiO2 + 2Mg ® Si + 2MgO
Кремний устойчив к кислотам (кроме смеси концентрированных HNO3 и HF), но растворим в щелочах:
Si + 2NaOH + H2O ® Na2SiO3 + 2H2
Оксид кремния(IV) является кислотным оксидом, но, имея полимерной строение, не растворяется в воде:
SiO2 + H2O ¹
Кремниевая кислота, очень слабая и нерастворимая в воде, может быть получена при действии кислот на ее соли - силикаты:
Na2SiO3 + 2HCl ® 2NaCl + H2SiO3¯
Кремниевая кислота при сильном нагревании разлагается на оксид кремния и воду. Силикаты натрия и калия растворимы в воде, силикаты других металлов - нерастворимы.
Гидроксиды олова и свинца имеют амфотерные свойства. При этом в степени окисления +2 в гидроксидах преобладают основные свойства, а в степени окисления +4 - кислотные.
SnCl2 + 2NaOH ® Sn(OH)2¯ + 2NaCl
Sn(OH)2¯ + 2HCl ® SnCl2 + 2H2O
Sn(OH)2¯ + 2NaOH ® Na2[Sn(OH)4]
SnCl4 + 4NH4OH ® H2SnO3¯ + 4NH4Cl + H2O
H2SnO3¯ + 2NaOH + H2O ® Na2[Sn(OH)6]
H2SnO3¯ + 4HCl ® SnCl4 + 3H2O
Соединения Sn2+ имеют восстановительные свойства, а соединения Pb4+ - окислительные:
SnCl2 + 2FeCl3 ® 2FeCl2 + SnCl4
PbO2 + 4HCl ® PbCl2 + Cl2 + 2H2O
Элементы VA группы имеют электронную формулу ns2np3. Азот, фосфор и мышьяк являются неметаллами, висмут и сурьма имеют металлические свойства. Наиболее характерные степени окисления: +5, +3, 0, -3. Оксиды Э2О5 имеют кислотные свойства, свойства оксидов Э2О3: кислотные - для N и P, амфотерные - для As и Sb, основные - для Bi.
Азот находится в природе в свободном состоянии в виде N2 (78% атмосферы). Связанный азот накапливается в растительном и животном мире - в организмах животных, например, от1 до 10% азота. Все важнейшие части клеток построены из белковых веществ. Без белка нет жизни, а без азота нет белка.
В промышленности азот получают сжижением воздуха, при последующем нагревании которого первым испаряется азот (tкип = -195,8оС) и лишь после него - кислород (tкип = -183,0оС).
При обычных температурах азот химически инертен, вследствие большой прочности его двухатомных молекул N2, имеющих тройную связь. Азот используется в промышленности для синтеза аммиака и дальнейшего получения азотных удобрений. Синтез аммиака идет при 320 - 1000 атм., при 500-550оС на железном катализаторе.
N2 + 3H2 ® 2NH3; DH = -46,36кДж/моль
Соединение азота в степени окисления -3 - аммиак NH3 - является бесцветным газом с резким запахом. Аммиак ядовит, легче воздуха, хорошо растворим в воде (в 1 объеме воды при 20оС растворяется 710 объемов аммиака) с образованием гидроксида аммония, который считается слабым основанием (К = 1,79×10-5):
NH3 + H2O ® NH3×H2O  NH4OH ® NH4+ + OH-
NH4OH ® NH4+ + OH-
Основные свойства аммиака проявляются и в реакциях с кислотами:
NH3 + НСl ® NH4Cl
Аммиак имеет восстановительные свойства (азот - в низшей степени окисления), реагируя с кислородом до азота при горении аммиака на воздухе или до NO в присутствии платинового катализатора при 600оС.
4NH3 + 3O2 ® 2N2 + 6H2O
4NH3 + 5O2  4NO + 6H2O
4NO + 6H2O
Наличие у атома азота в молекуле аммиака неподеленной пары электронов обуславливает донорные свойства аммиака, образующего комплексные соединения - аммиакаты:
CuSO4 + 4NH3 ® [Cu(NH3)4]SO4
Cоли аммония при нагревании разлагаются:
NH4Cl ® NH3 + HCl
NH4NO2 ® N2 + 2H2O
NH4NO3 ® N2O + 2H2O
В последней реакции мы получаем оксид азота (I) - N2O, называемый “веселящим” газом. Это безразличный оксид, разлагающийся при нагревании на азот и кислород. Безразличным оксидом является также и оксид азота(II) - NO, получаемый по следующим реакциям:
N2 + O2 ® 2NO при t>1000oC
3Cu + 8HNO3(разб.) ® 3Cu(NO3)2 + 2NO + 4H2O
Оксид азота(II) - NO, бесцветный газ, является восстановителем и легко окисляется кислородом, воздуха до оксида азота(IV) - NO2.
2NO + O2 ® 2NO2
Оксида азота(IV) - NO2 - газ бурого цвета, ядовит. При охлаждении димеризуется в бесцветный оксид N2O4. NO2 - сильный окислитель: уголь, сера, фосфор горят в нем, а оксид серы(IV) SO2 окисляется до оксида серы(VI) SO3. Оксида азота(IV) взаимодействует с водой и щелочами, проявляя кислотные свойства. При этом N+4 диспропорционирует на N+5 и N+3:
2NO2 + H2O ® HNO3 + HNO2
2NO2 + 2NaOH ® NaNO3 + NaNO2 + H2O
Оксид азота (III) N2O3 существует лишь при низких температурах. При t = 3,5oC кипит и разлагается:
N2O3 ® NO2 + NO
Этому оксиду соответствует слабая азотистая кислота HNO2 (K=4×10-4), которая существует лишь в разбавленных растворах и легко разлагается:
2HNO2 ® NO2 + NO + H2O
Соли азотистой кислоты - нитриты - устойчивы, для них характерны как окислительные, так и восстановительные свойства (азот - в промежуточной степени окисления):
2NaNO2 + 2KI + 2H2SO4 ® I2 + 2NO + K2SO4 + Na2SO4 + 2H2O
2KMnO4 + 3H2SO4 + 5NaNO2 ® 2MnSO4 + NaNO3 + K2SO4 + 3H2O
Разложение иодида азота(III) происходит с взрывом:
2NI3 ® N2 + 2I2
Гидратным соединением оксида азота(V) N2O5 является азотная кислота HNO3. Получение азотной кислоты и ее солей основано на синтезе аммиака, его окислении до NO, окислении NО до NO2 и взаимодействии NO2 с водой в присутствии кислорода воздуха:
N2 + 3H2 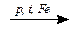 2NH3;
2NH3;
4NH3 + 5O2  4NO + 6H2O
4NO + 6H2O
2NO + O2 ® 2NO2
4NO2 + O2 + 2H2O ® 4HNO3
Азотная кислота - сильная кислота, ее соли хорошо растворимы в воде. Азотная кислота и ее соли - нитраты - являются окислителями (азот - в высшей степени окисления). Концентрированная азотная кислота не реагирует с Au и Pt, пассивирует на холоду Fe, Al, Cr, выделяет NO2 с тяжелыми металлами и N2O - с активными металлами:
Cu + 4HNO3 (конц.) ® Сu(NO3)2 + 2NO2 + 2H2O
4Ca + 10HNO3 (конц.) ® 4Сa(NO3)2 + N2O + 5H2O
Разбавленная кислота выделяет NO c тяжелыми металлами и N2 - c активными металлами, очень разбавленная кислота выделяет с активными металлами - NH3 - NH4NO3
3Cu + 8HNO3 (разб.) ® 3Сu(NO3)2 + 2NO + 4H2O
4Ca + 10HNO3 (оч.разб.) ® 4Сa(NO3)2 + NH4NO3 + 3H2O
Азотная кислота окисляет при нагревании некоторые неметаллы (S, P, C), при этом концентрированная кислота образует NO2, а разбавленная кислота - NO.
6HNO3 (конц.) + S ® 6NO2 + H2SO4 + 2H2O
5HNO3 (разб.) + 3P + 2H2O ® 5NO + 3H3PO4
Нитраты разлагаются при нагревании. Состав продуктов зависит от положения металла соли в ряду напряжений. При разложении нитратов металлов, стоящих в этом ряду левее магния, образуются нитриты и кислород, стоящих от магния до меди - оксиды металлов, оксид азота (IV) и кислород, стоящих после меди - свободные металлы, оксид азота (IV) и кислород:
2KNO3  2KNO2 + O2
2KNO2 + O2
2Cu(NO3)2  2CuO + 4NO2 + O2
2CuO + 4NO2 + O2
2AgNO3  2Ag + 2NO2 + O2
2Ag + 2NO2 + O2
Соли азотной кислоты (селитры) и соли аммония являются ценными минеральными удобрениями.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 897; Нарушение авторских прав?; Мы поможем в написании вашей работы!