
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Аллостерическая регуляция каталитической активности ферментов
|
|
|
|
Их роли в регуляции активности ферментов.
Общие представления о гормонах и
ЛЕКЦИЯ № 2
Лигазы (синтетазы)
Соединение 2 молекул с использованием энергии макроэргических соединений (АТФ и др). В реакцию вступают 3 вещества, образуется 3 вещества.
Систематическое название субстрат: субстрат – лигаза (источник энергии)
АТФ + L-глутамат + NH4+ → АДФ + Фн + L-глутамин
Систематическое название: L-глутамат: аммиак – лигаза (АТФ → АДФ + Фн)
Тривиальное название: глутаминсинтетаза
АТФ + ПВК + СО2 → АДФ + Фн + ЩУК
Систематическое название: ПВК: СО2 – лигаза (АТФ → АДФ + Фн)
Тривиальное название: пируваткарбокилаза
Тема: Регуляция активности ферментов в клетке.
Факультеты: лечебно-профилактический, медико-профилактический, педиатрический.
2 курс.
Одним из важнейших свойств живых организмов является способность к поддержанию гомеостаза. Гомеостаз в организме поддерживается за счет регуляции скорости ферментативных реакций. Эта регуляция осуществляется:
I). Доступностью молекул субстрата и кофермента;
II). Изменением каталитической активности молекул фермента;
III). Изменением количества молекул фермента.
I. Доступность молекул субстратов обеспечивается контролируемой работой трансмембранных транспортных систем. Например, количество в мембране ГЛЮТов (трансмембранных переносчиков глюкозы) определяет скорость поступления глюкозы в цитоплазму клеток и скорость метаболических процессов, в которых она используется (гликолиз, ПФШ, гликогенез).
Доступность коферментов зависит от скорости их регенерации. В результате, чем больше концентрация исходного субстрата и регенерированных коферментов, тем выше скорость метаболического пути. Например, дефицит НАД+ лимитирует реакции ЦТК.
II. Регуляция каталитической активности ферментов. Бывает:
1). Неспецифическая регуляция. В связи с лабильностью всех ферментов, их каталитическая активность зависит от температуры, рН и давления.
2). Специфическая регуляция. Под действием специфических активаторов и ингибиторов изменяется активность регуляторных ферментов, которые контролируют интенсивность метаболических процессов в организме.
Механизмы специфической регуляции каталитической активности ферментов:
1). Аллостерическая регуляция;
2). Регуляция с помощью белок-белковых взаимодействий;
3). Регуляция через ковалентную модификацию.
а). Регуляция путем фосфорилирования/дефосфорилирования фермента;
б). Регуляция частичным протеолизом.
Аллостерическими ферментами называют ферменты, активность которых регулируется обратимым нековалентным присоединением модулятора (активатора и ингибитора) к аллостерическому центру. Ингибиторами аллостерических ферментов часто являются конечные продукты метаболических путей, активаторами – их начальные субстраты.
Активирование происходит по принципу прямой положительной связи, а ингибирование - по принципу отрицательной обратной связи.

Аллостерические ферменты играют важную роль в регуляции т.к. чрезвычайно быстро реагируют на изменения среды.
Например, конечный продукт катаболизма глюкозы АТФ ингибирует аллостерически ферменты гликолиза фосфофруктокиназу и пируваткиназу. Накапливаемая в гликолизе фруктоза-1,6-ф активирует пируваткиназу, что ускоряет реакции гликолиза.
2). Регуляция каталитической активности ферментов с помощью белок-белковых взаимодействий. Выделяют 2 механизма:
а). Активация ферментов в результате присоединения регуляторных белков. Например, аденилатциклаза (Ац), которая катализирует превращение АТФ в цАМФ, активируется присоединением α-субъединицы G-белка. Этот механизм регуляции обратим.
б). Регуляция каталитической активности ферментов ассоциацией/диссоциацией протомеров. Например, протеинкиназа А, активируется при диссоциации ее тетрамера на 4 субъединицы и инактивируется при обратном соединении 4 субъединиц в тетрамер.
3). Регуляция каталитической активности ферментов путем их ковалентной модификации. Регуляция активности фермента осуществляется в результате ковалентного присоединения или отщепления от него фрагмента. Она бывает 2 видов:
а). путем фосфорилирования и дефосфорилирования ферментов;
б). путем их частичного протеолиза.
а). Регуляция каталитической активности ферментов путем их фосфорилирования и дефосфорилирования. Фосфорилирование осуществляется протеинкиназами (ПК) по ОН-группе серина, треонина или тирозина регуляторный белков и ферментов. Дефосфорилирование в этих же положениях осуществляется фосфопротеинфосфатазами (ФПФ).
Введение отрицательно заряженной фосфорной группы приводит к обратимому изменению конформации и активности фермента.
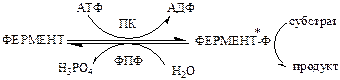
Например, под действием глюкагона и адреналина в клетках печени происходит фосфорилирование ключевых ферментов гликогенеза (гликогенсинтаза) и гликогенолиза (гликогенфосфорилаза), при этом распад гликогена активируется, а синтез ингибируется.
Инсулин наоборот вызывает в клетках печени дефосфорилирование тех же ключевых ферментов, в результате синтез гликогена активируется, а распад ингибируется.
б). Регуляция каталитической активности ферментов путем их частичного протеолиза. При участии активаторов и протеолитических ферментов происходит отщепление части молекулы фермента и его необратимая активация. Такой фермент функционирует короткий период, а затем разрушается. Подобная схема активации характерна для внеклеточных ферментов ЖКТ (пепсин, трипсин, химотрипсин и др.) и ферментов свертывающей и противосвертывающей системы крови (тромбин, фибрин, плазмин др.). Например, трипсиноген, синтезируемый в поджелудочной железе, поступает в двенадцатиперстную кишку, где энтеропептидаза кишечника отщепляет у него с N-конца гексапептид. В результате в оставшейся части молекулы фермента формируется активный центр.

|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1511; Нарушение авторских прав?; Мы поможем в написании вашей работы!