
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение молекул алканов
|
|
|
|
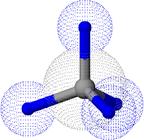
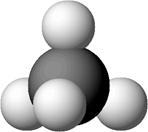
Каждый атом углерода в молекулах алканов образует четыре простые σ-связи с атомами водорода или другими атомами углерода. Электронные орбитали атомов углерода находятся в состоянии sp3 - гибридизации. Гибридные орбитали, а, значит, и связи каждого атома углерода направлены к вершинам тетраэдра (рис. 1).
 |
 а
а
| б |
Рисунок 1. Модели молекул метана: а – полусферическая; б – шаростержневая (показано распределение электронной плотности).
Валентный угол в молекуле метана и его гомологов составляет 109,5◦. Поэтому углеродная цепь в молекулах алканов имеет зигзагообразную форму:
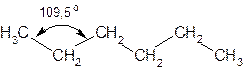
Вокруг σ-связей С-С возможно вращение, в результате которого молекулы могут принимать различные формы, называемые конформациями (рис. 2).
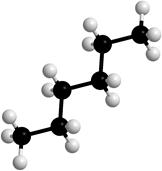

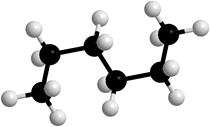
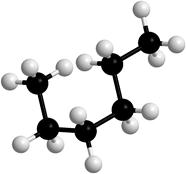
Рисунок 2. Модели молекулы гексана в разных конформациях.
Углеродный скелет молекул алканов может иметь как нормальное, так и разветвленное строение. В молекулах гомологов метана различают первичные, вторичные, третичные и четвертичные атомы углерода (см. приложение 1).
Связи С-С в молекулах алканов являются ковалентными неполярными, а связи С-Н – ковалентными полярными. Однако значения электроотрицательности атомов углерода и водорода близки и равны соответственно 2,5 и 2,1 по Полингу. Поэтому по свойствам связь С-Н близка к неполярной и проявляет склонность к гомолитическому разрыву с образованием свободных радикалов:
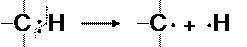 .
.
Следовательно, для алканов характерны реакции, протекающие по радикальному механизму.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1009; Нарушение авторских прав?; Мы поможем в написании вашей работы!