
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окисление
|
|
|
|
Для спиртов характерны реакции горения с образованием углекислого газа и воды, а также реакции окисления, приводящие к получению альдегидов, кетонов и карбоновых кислот. В лабораторных условиях для окисления спиртов обычно используют подкисленные растворы перманганата или дихромата калия, оксид меди и т.д.
При окислении первичных спиртов сначала образуются альдегиды, которые, в свою очередь, могут окислиться до карбоновых кислот:
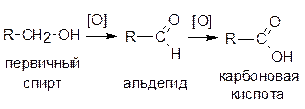
Вторичные спирты окисляются до кетонов:
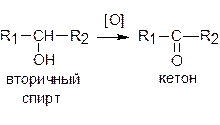
Третичные спирты могут окисляться только с разрывом связей углерод-углерод.
Приведем примеры реакций. Окисление этанола K2Cr2O7 или KMnO4 приводит к образованию этаналя:
3С2H5OH + K2Cr2O7 + 4H2SO4 =
3CH3CHO + 2Cr2(SO4)3 + K2SO4 + 7H2O.
Если образовавшийся альдегид не выделить сразу из реакционной смеси, то он будет окисляться дальше, и конечным продуктом реакции будет этановая (уксусная) кислота:
3С2H5OH + 2K2Cr2O7 + 8H2SO4 =
3CH3COOH + 2Cr2(SO4)3 + 2K2SO4 + 11H2O.
В качестве окислителя можно использовать нагретый оксид меди (II):

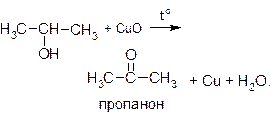
Для проведения этой реакции обычно из медной проволоки делают спираль, нагревают ее до образования на поверхности черного налета CuO и, не давая остыть, опускают в спирт. Появляется характерный запах альдегида, черный налет исчезает, и проволока снова приобретает характерный для меди розово-красный цвет. Эту реакцию можно считать качественной пробой на спирты.
Превращение спиртов в альдегиды можно осуществить и путем дегидрирования, протекающего при пропускании паров спиртов над нагретым металлическим катализатором, например, медью:


С формальной точки зрения эти реакции также можно отнести к реакциям окисления спиртов.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1470; Нарушение авторских прав?; Мы поможем в написании вашей работы!