
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Встановлення точки еквівалентності за допомогою індикаторів
|
|
|
|
Існують різні способи визначення точки еквівалентності. Наприклад, для визначення точки еквівалентності можна застосувати індикатор або ввести в розчин певний металевий електрод і в процесі титрування вимірювати його потенціал. В останньому випадку точку еквівалентності знаходять за аналізом залежності зміни потенціалу від об'єму добавленого робочого розчину. Це спосіб потенціометричного титрування.
Розглянемо докладніше індикаторний спосіб визначення точки еквівалентності, як найбільш простий і доступний.
Індикатори – хімічні сполуки, за допомогою яких установлюють точку еквівалентності. Ідикаторами можуть бути речовини, здатні вступати в хімічні реакції з робочим розчином при певній його концентрації (або з визначуваною речовиною ), причому утворені продукти реакції легко помітити неозброєним оком. Продукт реакції може бути розчинною забарвленою сполукою або кольоровим чи безбарвним осадом. Отже, індикатори – це органічні барвники складної будови зі слабкими кислотними або основними властивостями, які змінюють своє забарвлення залежно від рН середовища.
Індикатори поділяються на окремі групи за різними принципами: технікою застосування, оборотністю форм, в яких індикатори існують, типом хімічної реакції, яка лежить в основі визначення за допомогою даного індикатору.
Зовнішні і внутрішні індикатори. За технікою застосування розрізняють внутрішні і зовнішні індикатори. Внутрішні індикатори – речовини, що вводяться для встановлення точки еквівалентності безпосередньо в розчин, який титрують. Такі індикатори найзручніші, тому дуже поширені. Кінцеву точку титрування розпізнають за зміною кольору індикатора в розчині або за появою чи зникненням осаду. Іноді внутрішніми індикаторами користуватись незручно або неможливо, тоді застосовують зовнішні індикатори. Це буває, наприклад, тоді, коли при титруванні утворюються забарвлені осади, що маскують зміну кольору індикатора. Визначення з зовнішнім індикатором ведуть, відбираючи в процесі титрування час від часу краплину розчину і встановлюючи за допомогою якісної реакції присутність у розчині йонів, які визначають. Перше титрування звичайно вважають орієнтовним. При повторному титруванні, коли вже приблизно відома кількість робочого розчину, що витрачається на визначення, добавляють одразу майже всю цю кількість розчину і роблять краплинні проби на йони, які визначають тільки поблизу точки еквівалентності. Для титрування із зовнішніми індикаторами треба мати досить великий практичний досвід і витратити значно більше часу, ніж для титрування з внутрішніми індикаторами. Тому такі визначення застосовують порівняно рідко.
Оборотні і необоротні індикатори. Оборотні індикатори – сполуки, які здатні існувати в двох формах, причому реакція переходу однієї форми в іншу і навпаки є оборотною. Механізм зміни забарвлення індикатора пояснюють йонною теорією Оствальда, суть якої зводиться до того, що молекули та йони індикатора мають різне забарвлення. До цього типу належить більшість відомих індикаторів. Прикладом оборотних індикаторів є метилоранж. У лужному середовищі він забарвлений у жовтий колір, а в кислому – в червоний. Зміна червоного забарвлення на жовте або навпаки може відбуватися в обох напрямах багато разів залежно від присутності в розчині надлишку кислоти чи лугу. Оборотні індикатори зручні й тим, що при випадковому введенні надто великої кількості робочого розчину визначення все-таки можна закінчити правильно: для цього до перетитрованого розчину треба добавити ще певну кількість визначуваної речовини (при цьому індикатор відновить свій попередній колір) і обережно дотитрувати розчин.
Оборотні індикатори бувають одноколірними (наприклад, фенолфталеїн) або двоколірними (наприклад, метиловий оранжевий, метиловий червоний та ін.).
Одноколірні індикатори мають забарвлення лише в одній, звичайно йонній формі. Молекулярна форма цих індикаторів безбарвна. Двокольорні індикатори забарвлені і в молекулярній, і в йонній формі. Колір цих форм різний і залежить від рН середовища.
Необоротні індикатори – це сполуки, які під впливом надлишку реактиву руйнуються, і попереднє забарвлення яких не відновлюється від добавляння надлишку визначуваної речовини. Прикладом необоротних індикаторів може бути той самий метилоранж, якщо він застосовується при титруванні розчином калій бромату. Робочий розчин калій бромату використовують при визначенні тривалентних миш'яку, сурми і деяких інших відновників. До того часу, поки в розчині є йони миш'яку чи сурми, калій бромат витрачається на їх окиснення і не реагує (або майже не реагує) з метилоранжем. Після досягнення точки еквівалентності калій бромат вступає в реакцію з метилоранжем, причому відбувається необоротне окиснення метилоранжу. Недоліком необоротних індикаторів є те, що їх забарвлення часто слабшає і навіть повністю зникає ще до точки еквівалентності. Це спостерігається в тих випадках, коли розчин погано перемішують, і пояснюється місцевим надлишком реактиву, який створюється під час титрування в окремих місцях розчину. Тому в процесі титрування часто доводиться добавляти ще нові порції індикатора, щоб пересвідчитись в тому, що забарвлення індикатора зникло внаслідок введення надлишку робочого розчину, а не внаслідок поступового окиснення індикатора під час добавляння робочого розчину.
Індикатори розрізняють ще за типом хімічної реакції, що лежить в основі визначення. Відповідно до цього існує кілька груп індикаторів.
Індикатори методів кислотно-основного титрування. Це забарвлені речовини органічного походження, які здатні існувати в двох формах, залежно від величини рН розчину. Вони належать до групи оборотних індикаторів. Найчастіше обидві форми цих індикаторів забарвлені в різний колір – так звані двоколірні індикатори. Рідше використовуються індикатори одноколірні, тобто такі, в яких забарвлена тільки одна форма. Кислотно-основні індикатори реагують на зміну концентрації водневих йонів і в цьому розумінні є специфічними індикаторами на водневі йони.
Індикатори методів окиснення-відновлення. Більшість цих індикаторів є також органічними речовинами, що можуть існувати в двох формах – окисненій і відновленій. Але, на відміну від кислотно-основних індикаторів, вони не специфічні відносно певних йонів, їх забарвлення змінюється, як правило, залежно від зміни величини окисно-відновного потенціалу розчину. Майже всі індикатори методів окиснення-відновлення – оборотні.
Індикатори методів осадження. Ці індикатори здебільшого характеризуються специфічною дією відносно певних йонів. У цій групі слід окремо виділити так звані адсорбційні індикатори. Адсорбційні індикатори – це барвники, які адсорбуючись на поверхні осаду, що утворюється під час титрування, різко змінюють його забарвлення. Як адсорбуючі індикатори використовують: флуоресцеїн, дихлорфлуоросцеїн, йод еозин та ін.
Індикатори – це не просто будь-які речовини, що дають з реактивом А або з речовиною В забарвлені чи малорозчинні сполуки.
Ііндикатор повинен реагувати з реактивом А, що застосовується для титрування (чи з визначуваною речовиною В) при такій концентрації останнього, яка має бути в точці еквівалентності.
При розгляді процесів титрування замість концентрації реагуючих речовин зручно користуватись десятковим логарифмом числового значення концентрації, взятим з оберненим знаком – від'ємним логарифмом концентрації. Позначимо від'ємний логарифм концентрації реактиву А в точці еквівалентності -lg Aекв через рАекв; від'ємний логарифм концентрації реактиву А, при якій останній вступає в реакцію з індикатором, – через рТ. Величина рТ називається показником титрування індикатора. Умовою правильного визначення точки еквівалентності за допомогою того чи іншого індикатора є рівність цих двох величин: рАекв = рТ.
Аналогічно до цього, коли індикатор реагує з речовиною В (а не з реактивом А), найбільш сприятливою умовою точного визначення буде:
рВекв = рТ.
Додержати рівності величин рАекв (рВекв) і рТ досить важко. Виконання цієї умови означало б потребу мати для титрування кожної речовини окремий індикатор. Звичайно в практиці при визначенні різних речовин часто застосовують один і той самий індикатор, допускаючи деяку нерівність величин рАекв (рВекв) і рТ. Це призводить до того, що індикатор фіксує кінець титрування раніше або пізніше, ніж буде досягнуто точки еквівалентності. Момент титрування, коли спостерігається зовнішній ефект реакції між індикатором і робочим розчином реактиву (чи визначуваною речовиною), називають кінцевою точкою титрування.
Розбіжність між кінцевою точкою титрування і точкою еквівалентності є причиною виникнення помилки титрування; проте в більшості випадків, якщо розходження між рАекв (рВекв) і рТ не виходить за певні межі, помилка титрування незначна і нею можна нехтувати. Важливо вміти визначити допустиму розбіжність величин рАекв (рВекв) і рТ, яка дає змогу провести титрування з достатньою точністю. Для цього застосовують залежності, які характеризують зміни концентрації реагуючих речовин у процесі титрування, так звані криві титрування.
Графічна залежність зміни концентрації визначуваної речовини В від об'єму робочого розчину реактиву А називається кривою титрування. При титруванні концентрації В і А, як правило, змінюються дуже часто в мільйони і десятки мільйонів разів. Для зручності графічного позначення таких великих змін концентрації звичайно користуються логарифмічною залежністю, відкладаючи на осі ординат величину від'ємного логарифма концентрації -lg В або -lg А; на осі абсцис відкладають об'єм робочого розчину в см3 (мл). Зазвичай крива титрування будується з припущенням, що об'єм розчину під час титрування не змінюється. Практично цього можна досягти, застосовуючи, наприклад, концентрований розчин реактиву, або вводячи останній у сухому вигляді. Це зроблено для того, щоб мати можливість дослідити залежність -lg В від об'єму робочого розчину реактиву в чистому вигляді і виключити вплив розведення, при добавлянні робочого розчину, на концентрацію В.

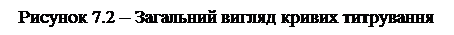
Загальний вигляд типової кривої титрування показано на рисунок 7.2 безперервною лінією. Абсциса точки Е позначає кількість мілілітрів робочого розчину А, витраченого на титрування до досягнення точки еквівалентності; ордината цієї точки рВекв відповідає концентрації речовини В у точці еквівалентності.
Важлива властивість кривої титрування, як видно з рисунка, полягає в тому, що концентрація В під час титрування змінюється нерівномірно; спочатку із збільшенням об'єму робочого розчину А вона зменшується мало – полога нижня частина кривої. У міру наближення до точки еквівалентності це зменшення стає більш різким і, нарешті, в точці еквівалентності досягає максимального значення. Після точки еквівалентності концентрація В знову змінюється повільніше – права верхня частина кривої.
З рисунок 7.2 видно, що інтервал різкої зміни концентрації В біля точки еквівалентності (стрибок титрування) досить значний. Ця обставина має велике значення для правильного визначення точки еквівалентності за допомогою індикаторів. Наприклад, індикатор дає забарвлену сполуку з речовиною В при такій концентрації останньої, яка відповідає величині рТ (рисунок 7.2). Отже, на початку титрування розчин буде забарвлений; коли концентрація зменшиться до величини рТ зміна кольору індикатора вкаже на досягнення кінцевої точки титрування. У цьому випадку кінцева точка титрування настане до того, як буде досягнута точка еквівалентності. Тому розчин буде трохи недотитрований, причому причиною цього є розходження між величинами рТ і рВекв: рВекв – рТ = a (треба пам'ятати, що на осі ординат відкладено від'ємний логарифм концентрації В, тому підйом кривої відповідає зменшенню концентрації В). Отже виникає помилка титрування.
Помилки титрування – відношення кількості (концентрації) невідтитрованої частини речовини В у кінцевій точці титрування до її загальної кількості (концентрації) на початку титрування. В тому випадку, коли розчин у кінцевій точці титрування перетитрований, помилку титрування визначимо відношенням зайвої кількості введеного робочого розчину до початкової кількості речовини. У нашому прикладі невідтитровану частину можна характеризувати відрізком l на абсцисі, а загальну кількість речовини В – відрізком m. З рисунку видно, що в цьому випадку помилка незначна, це зумовлено дуже різкою зміною концентрації В поблизу точки еквівалентності. Тому навіть досить значне розходження між рТ і рВекв мало відбивається на точності титрування.
Розглянемо тепер вплив зміни початкової концентрації В на форму кривої титрування і на точність останнього. Припустимо, що початкова концентрація розчину В у десять раз менша, ніж у попередньому випадку. Тоді нижня полога частина кривої піде трохи вище, ніж раніше. Вигляд цієї кривої титрування показано на рисунок 7.2 пунктиром. У цьому випадку таке саме відхилення рТ від pВeкв призводить до значно більшої помилки титрування, яка визначається відношенням відрізків п і т.
З розглянутого вище випливає:
ü помилка титрування збільшується із збільшенням розходженння між величинами рВекв і рТ;
ü точність титрування розведених розчинів завжди менша, ніж концентрованих, тому в об'ємному аналізі користуються звичайно розчинами з Сн = 0,1.
Точність титрування збільшується також із зменшенням швидкості зворотної реакції між А і В. Тому при титруванні, наприклад, методом осадження треба вибирати такі робочі розчини, які при взаємодії з визначуваною речовиною давали б найменш розчинні сполуки. Так, титрування йонів Арґентуму йонами йодиду дає точніші результати, ніж титрування йонами хлориду. Це пояснюється меншою розчинністю осаду Agl порівняно з осадом AgCl. У цих випадках інтервал різкої зміни концентрації речовини В поблизу точки еквівалентності буде досить значним. Тому навіть помітна розбіжність між величинами рВекв і рТ не призведе до великої помилки титрування.
Контрольні питання
1. Який посуд і для яких операцій використовують у об’ємному методі аналізу?
2. Опишіть два способи приготування робочих розчинів у об’ємному методі аналізу.
3. Методика проведення прямого титрування.
4. Методика проведення зворотного титрування.
5. Що називається точкою еквівалентності?
6. Які існують способи визначення точки еквівалентності?
7. Які речовини називають індикаторами? За якими принципами класифікують індикатори?Що називають показником титрування індикатору?
8. Яка умова є обов’язковою для правильного встановлення точки еквівалентності?
9. Яку залежність називають «кривою титрування»? Для чого будують криві титрування?
10. Чому виникають помилки титрування? Які фактори впливають на точність титрування?
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2821; Нарушение авторских прав?; Мы поможем в написании вашей работы!