
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Йодометричне визначення активного хлору в хлорному вапні
|
|
|
|
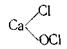 Хлорне вапно CaCl2O або Ca(OCl)2 – це змішана сіль хлоридної і гіпохлоритної кислот або кальцій (ІІ) гіпохлорит. Будову молекул цієї солі можна зобразити такою структурною формулою:
Хлорне вапно CaCl2O або Ca(OCl)2 – це змішана сіль хлоридної і гіпохлоритної кислот або кальцій (ІІ) гіпохлорит. Будову молекул цієї солі можна зобразити такою структурною формулою:
Технічний препарат містить, крім того, значну частину кальцій оксиду, кальцій хлориду та деяких інших речовин. Хлорне вапно застосовується для дезинфекції, біління тканин, дегазації отруйних речовин тощо. Якість препарату оцінюється вмістом «активного хлору», тобто хлору, що виділяється при взаємодії хлорного вапна із соляною кислотою:
CaCl2O + 2HCl ® CaCl2 + Cl2 + H2O
В основі йодометричного методу визначення активного хлору в хлорному вапні лежать реакції:
CaCl2O + 2KI + 2HCl ® CaCl2 + 2KCl + I2 + H2O
I2 + 2Na2S2O3 ® Na2S4O6 + 2NaI
Порядок визначення. На аналітичних терезах зважують близько 0,15 г хлорного вапна в бюксі (оскільки хлорне вапно гігроскопічне) з точністю до 0,0001 г.
Наважку переносять у конічну колбу на 250 см3, доливають 25 см3 води, вміст колби збовтують і вносять 1 г калій йодиду і 15 см3 сульфатної кислоти H2SO4 з Сн = 4,0. Суміш перемішують і титрують йод, що виділився, розчином натрій тіосульфату з Сн = 0,05, поки колір суспензії стане світло-жовтим. Після цього добавляють 2 см3 0,2 % розчину крохмалю і титрують далі. У точці еквівалентності синє забарвлення зникає, і суспензія набуває білого кольору.
Результати аналізу обчислюють за формулою:
де – молярна концентрація еквіваленту і об’єм витраченого на титрування розчину натрій тіосульфату;  - еквівалентна маса хлору, яка, як це видно з рівняння, чисельно дорівнює атомній масі хлору; q – наважка в грамах.
- еквівалентна маса хлору, яка, як це видно з рівняння, чисельно дорівнює атомній масі хлору; q – наважка в грамах.
Контрольні питання.
1. На чому ґрунтуються методи оксидиметрії та як їх класифікують?
2. Які типи індикаторів застосовують в оксидиметрії?
3. Який робочий розчин та індикатор застосовують у перманганатометрії?
4. Які речовини і навіщо застосовують як вихідні у перманганаометрії?
5. Для яких аналізів застосовують метод перманганатометрії?
6. Сутність йодометрії. Які індикатори застосовують в йодометрії та в чому їх особливість?
7. Який розчин використовують як робочий у йодометрії?
8. Які речовини є вихідними у йодометрії?
9. Для яких аналізів застосовують йодометричний метод?
10. Як обчислюють масову частку речовини (у %) у препараті за результатами титрування?
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1707; Нарушение авторских прав?; Мы поможем в написании вашей работы!