
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия
|
|
|
|
Пример 1. В каком из следующих процессов следует ожидать наибольшего и наименьшего изменения энтропии:
1) H2 (г) + 0,5O2 (г) = H2O (ж);
2) H2 (г) + 0,5 O2 (г) = H2O (г);
3) C2H6 (г) + 3,5O2 (г) = 2 CO2 (г) + 3 H2O (г);
4) KClO3 (к) = KCl (к) + 1,5 O2 (г).
Решение. Знак и величину DS процесса можно оценить, не производя вычислений, если вспомнить, что энтропия газа существенно больше энтропии жидкости и тем более – кристаллического вещества. Поэтому, определяя, насколько число молей газообразных веществ в правой части уравнения больше числа молей газообразных веществ в левой части уравнения, приходим к выводу, что наибольшая положительная энтропия характеризует четвертый процесс. Энтропии первого и второго процессов отрицательны, наибольшая отрицательная энтропия соответствует первому процессу.
Пример 2. Пользуясь справочными данными, определить стандартную энтропию образования K2Cr2O7 (к).
Решение. Искомая величина – это DSо следующего процесса:
2K (к) + 2Cr (к) + 3,5 O2 (г) = K2Cr2O7 (к).
Эта величина может быть найдена на основе соотношения (1.18):
DS0 = S0 K2Cr2O7 (к) – 2S0 K (к) – 2S0 Cr (к) – 3,5S0 02 (г) =
= 291 – 2×64,48 – 2×23,6 – 3,5×205,0 = – 603,1 Дж/К.
Пример З. Пользуясь справочными данными, определить возможность самопроизвольного протекания при 298,15 К следующих процессов в изолированных системах:
1) KClO3 (к) = KCl (к) +1,5 O2 (г);
2)  N2 (г) + 2H2 (г) +
N2 (г) + 2H2 (г) +  Cl2 (г) = NH4Cl (к).
Cl2 (г) = NH4Cl (к).
Решение. Для изолированных систем критерием самопроизвольного течения процесса является положительное значение энтропии. Поэтому, пользуясь справочными данными, вычисляем для указанных процессов
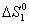 = S0 KCl (к) + 1,5S0 O2 (г) – S0 KClO3 (к) =
= S0 KCl (к) + 1,5S0 O2 (г) – S0 KClO3 (к) =
= 82,6 + 1,5×205,0 – 143,0 = 247,1 кДж/К;
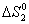 = S0 NH4Cl (к) – 0,5S0 N2 (г) – 2S0 H2 (г) – 0,5S0 Cl2 (г) =
= S0 NH4Cl (к) – 0,5S0 N2 (г) – 2S0 H2 (г) – 0,5S0 Cl2 (г) =
= 95,8 – 0,5×191,5 – 2×130,5 – 0,5×223,0 = – 372,5 Дж/К.
В результате делаем вывод, что в изолированной системе первый процесс разрешен в самопроизвольном течении, а второй - запрещен.
|
|
|
Дата добавления: 2014-01-04; Просмотров: 656; Нарушение авторских прав?; Мы поможем в написании вашей работы!