
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Шкала термодинамических функций образования ионов в водных растворах. Для теории растворов электролитов большое значение имеет понятие бесконечно разбавленный раствор
|
|
|
|
Для теории растворов электролитов большое значение имеет понятие " бесконечно разбавленный раствор ". Это такой раствор, в котором 1 моль растворенного вещества приходится на бесконечно большое число молей растворителя. Бесконечно разбавленный раствор обладает следующими свойствами. Во-первых, любой электролит в нем полностью диссоциирован на ионы. Во-вторых, поскольку между ионами в таком растворе бесконечно большие расстояния, то взаимодействие между ними полностью отсутствует. Другими словами, в бесконечно разбавленном растворе ионы ведут себя независимо, и любое свойство электролита будет аддитивно слагаться из свойств составляющих его ионов.
Любое свойство индивидуального иона, например термодинамическое, не может быть объективно определено. В таких ситуациях (см., например, раздел 1.6) прибегают к построению шкалы относительных величин, в которой значение рассматриваемого свойства для одной из систем постулируется, а значения свойства других систем отсчитываются от принятого значения. В частности для водных растворов электролитов шкала термодинамических функций образования ионов строится на основе следующих допущений:
DH0обр H+(р-р, ¥ H2O) = 0;
DG0обр H+(р-р, ¥ H2O) = 0; (3.10)
S0 H+(р-р, ¥ H2O) = 0.
Поскольку понятие бесконечно разбавленного раствора используется в определении стандартного состояния для растворов (см. раздел 1.2), то правильнее (по крайней мере, в отношении величин DG), следует писать не (р-р, ¥ H2O), а (р-р, ст.с.). Обратим внимание также на то, что хотя энтропии веществ могут быть только положительными (см. раздел 1.3), энтропии индивидуальных ионов, являющиеся относительными величинами, могут быть и отрицательными.
Константа диссоциации любого электролита в принципе может быть найдена на основе соотношения (2.12), связывающего в данном случае стандартную энергию Гиббса процесса диссоциации электролита с константой равновесия, каковой и является константа диссоциации. В свою очередь стандартная энергия Гиббса процесса диссоциации электролита находится согласно закона Гесса как разность стандартных энергий Гиббса образования ионов и недиссоциированного электролита. Для последнего возникает проблема – с одной стороны, стандартное состояние для недиссоциированного электролита соответствует раствору со свойствами бесконечно разбавленного; с другой стороны, при бесконечном разбавлении любой электролит полностью распадается на ионы и говорить о недиссоциированном электролите вообще не приходится. Эта проблема решается введением для растворов дополнительного стандартного состояния – раствор, стандартное состояние, гипотетически недиссоциированный (р-р, ст.с., гип. недис.). Иными словами, электролит находится в растворе со свойствами бесконечно разбавленного, но при этом не диссоциирует на ионы. Например, необходимо определить константу диссоциации синильной кислоты при 298,15 К по термодинамическим данным.
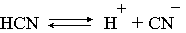
В соответствии с уравнением диссоциации
DG0дис = –RTlnКдис = DG0обр H+ (р-р, ст.с) + DG0обр CN–(р-р, ст.с) –
– DG0обр HCN (р-р, cт.с., гип. недис) = 0 + 171,6 – 119,0 = 52,6 кДж
находим константу диссоциации по соотношению:
Кдис = 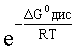 =
= 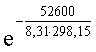 = 6,0×10–10.
= 6,0×10–10.
Введение в раствор электролита общего с ним иона в соответствии с принципом Ле Шателье ведет к уменьшению степени диссоциации электролита. Так, например, растворение КСN в упоминавшемся растворе НСN ведет к уменьшению диссоциации.
Остановимся еще дополнительно на термодинамических функциях образования растворов. Энтальпия образования раствора данного соединения определенной концентрации равна стандартной энтальпии образования этого соединения плюс энтальпия его растворения с образованием раствора нужного состава. Если происходит растворение с образованием бесконечно разбавленного раствора, то получаем стандартную энтальпию образования соединения в состоянии раствора. Напомним, если растворяемое соединение является электролитом, то его стандартная энтальпия образования равна сумме стандартных энтальпий образования ионов.
|
|
|
Дата добавления: 2014-01-04; Просмотров: 757; Нарушение авторских прав?; Мы поможем в написании вашей работы!