
- Р Р‡.МессенРТвЂВВВВВВВВжер
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВВВВВРЎР‚
- LiveJournal
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергетические уровни атома. Квантовые числа
|
|
|
|
Состояние атома можно охарактеризовать через состояние его электронов. Электрон – движущаяся заряженная частица, поэтому для его характеристики необходимы четыре величины: два механических момента импульса и два магнитных момента.
Орбитальный момент импульса и орбитальный магнитный момент обусловлены вращением электрона вокруг ядра.
Собственный момент импульса (спин) и спиновой магнитный момент обусловлены вращением электрона вокруг собственной оси.
С моментами связаны квантовые числа. Их также четыре:
1. Главное квантовое число: n = 1, 2, 3,… (числа натурального ряда). Характеризует местонахождение электрона в атоме, его удалённость от ядра. В модели Резерфорда-Бора определяет радиусы круговых орбит вращения электронов вокруг ядра. Радиусы должны удовлетворять условию квантования (орбитальный момент импульса электрона кратен постоянной Планка):
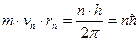 , где
, где
m – масса электрона,
vn – скорость электрона на данной орбите,
rn – радиус орбиты.
Чем больше n, тем дальше от ядра орбита, больше скорость и энергия электрона на этой орбите и энергия атома в целом.
Боровская модель атома – удобное приближение, однако на самом деле невозможно точно указать одновременно энергию электрона и его местонахождение.
Электронная орбита – лишь наиболее вероятная область локализации электрона в атоме.
Совокупность всех электронов с одинаковым квантовым числом n – электронный слой. Изменение n – переход из одного электронного слоя в другой.
2. Орбитальное квантовое число: l = 0, 1, 2, …, n -1 (целые числа от нуля до «n -1»). В рамках Боровской модели характеризует форму электронной орбиты.
3. Магнитное квантовое число: ml = 0, 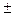 1,
1, 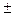 2, …
2, … 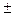 n. Характеризует пространственное расположение орбиты, определяет проекцию орбитального магнитного момента электрона на вектор напряжённости внешнего магнитного поля.
n. Характеризует пространственное расположение орбиты, определяет проекцию орбитального магнитного момента электрона на вектор напряжённости внешнего магнитного поля.
4. Спиновое квантовое число: ms = 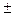 ½. Определяет проекцию спинового магнитного момента электрона на вектор напряжённости внешнего магнитного поля.
½. Определяет проекцию спинового магнитного момента электрона на вектор напряжённости внешнего магнитного поля.
При изменении любого из четырёх квантовых чисел меняется энергетическое состояние как электрона, так и атома в целом.
Система энергетических уровней и подуровней молекулы.
Внутренняя энергия молекулы включает следующие составляющие:
1. Энергия движения электронов в атомах (Eэл)
2. Энергия колебательного движения атомов в молекуле (Екол)
3. Энергия вращательного движения самой молекулы как целого (Евр)
Ем = Еэл + Екол + Евр
Энергия колебательного и вращательного движения тоже квантуется, следовательно, у молекулы появляются дополнительные энергетические подуровни:
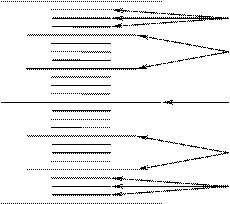 вр.
вр.
кол.
эл.
кол.
вр.
Кванты уменьшаются в ряду: Еэл → Екол → Евр. Поэтому радиоволны СВЧ-диапазона и дальний ИК-свет возбуждают лишь переходы между вращательными уровнями. Близкий ИК-свет – переходы между колебательными и вращательными уровнями. В области видимого и УФ-света – все три вида переходов (между электронными, колебательными и вращательными уровнями).
|
|
|
Дата добавления: 2014-01-04; Просмотров: 890; Нарушение авторских прав?; Мы поможем в написании вашей работы!