
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Прямая потенциометрия
|
|
|
|
ВИДЫ ПОТЕНЦИОМЕТРИЧЕСКОГО АНАЛИЗА
Потенциометрические методы анализа подразделяются на два вида:
- прямая потенциометрия, или ионометрия;
- потенциометрическое титрование.
Метод прямой потенциометрии основан на определении концентрации иона непосредственно по измеренной ЭДС электрохимической цепи, содержащей соответствующий ионоселективный электрод.
Расчет может быть выполнен по указанному выше уравнению Нернста, известны все параметры, входящие в это уравнение. Однако величины fан и Едиф заранее неизвестны, поэтому используют приемы, позволяющие обойти эти трудности (метод градуировочного графика и метод добавок).
Метод градуировочного графика. Для этого заранее строят градуировочный график в координатах ЭДС - lgСан с использованием стандартных растворов анализируемого иона, имеющих одинаковую ионную силу paствора.
В этом случае fан и Едиф остаются постоянными и график становится линейным. Затем по той же ионной силе измеряют ЭДС цепи с анализируемым раствором и по графику определяют концентрацию раствора. Пример определения приведен на рис. 1.
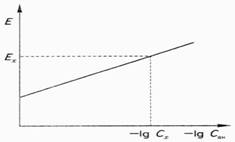
Рис.1. Градуировочный график для определения концентрации методом прямой потенциометрии
Метод добавок.
Это группа методов, основанная на введении в анализируемый раствор добавки раствора анализируемого иона с известной концентрацией. Добавка может быть одноразовой - метод единичной добавки; двухразовой - метод двойной добавки; многоразовой - метод многократных добавок.
Рассмотрим принцип этого метода на примере единичной добавки. Для этого предварительно определяют крутизну S электродной функции применяемого ионоселективного электрода. Затем измеряют ЭДС и Ех в точно отмеренном объеме Vaн анализируемого раствора. После этого в раствор вводят точно отмеренный объем добавки Vдоб с концентрацией Сан анализируемого иона и измеряют изменение ЭДС ∆E. Если Vан >> Vдоб, то разведением раствора пренебрегают и концентрацию анализируемого раствора Сан рассчитывают по формуле: Сан = (С доб · Vдоб) / Vан (10∆E / S - 1)
Введение добавки при указанных условиях существенно не изменяет ионную силу раствора. Следовательно, величины Едоб и fан остаются прежними при нахождении ∆E сокращаются. Поэтому при применении метода добавок нет необходимости регулировать ионную силу раствора для поддержан постоянства Едоб и fан. Метод добавок в ионометрии используют наиболее часто и в различных его вариантах.
Ионометрия характеризуется высокой экспрессностью, достаточно высокой точностью и селективностью. Метод нашел применение в различных областях химии, в биохимии, медицине и фармации. Этот метод рекомендуется для фармацевтического анализа. Потенциометрическое титрование
Метод потенциометрического титрования основан на определении точки эквивалентности по резкому изменению в ней ЭДС электрохимической цепи, содержащей индикаторный электрод. Как следует из основного уравнения потенциометрии, при резком изменении концентрации иона в точке эквивалентности происходит и резкое изменение ЭДС.
Из этого следует, что индикаторный электрод должен быть селективным к одному из реагирующих ионов титруемой системы. Например, при кислотно-основном титровании в качестве индикаторного электрода может быть использован Н+ -ионоселективный (стеклянный) электрод; при аргентометрических титрованиях - селективный либо к иону серебра, либо к соответствующему галогенид-иону. При окислительно-восстановительном титровании необходимо использовать окислительно-восстановительный электрод, способный реагировать на изменение окислительно-восстановительного потенциала в титруемой системе (например платиновый). В потенциометрическом титровании можно использовать все виды титрования: кислотно-основное, осадительное, комплексиметрическое и окислительно-восстановительное.
Точку эквивалентности при потенциометрических титрованиях определяют графическим методом на кривой титрования. Обычно используют одну из следующих видов кривых титрования: интегральную, дифференциальную или кривую Грана, вид которых приведен на рис. 2.
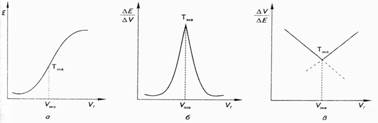
Рис. 2. Кривые потенциометрического титрования:
а - интегральная кривая титрования; б - дифференциальная кривая титрования; в - кривая титрования Грана
Интегральная кривая титрования (рис. 2, а) строится в координатах E - VТ. Точка эквивалентности находится в середине скачка титрования. Дифференциальная кривая титрования (рис. 2, б) строится в координатах:
∆Е / ∆V- VT. Точка эквивалентности находится в вершине кривой титрования. Дифференциальная кривая титрования дает более точное определение точки эквивалентности, чем интегральная.
Кривая титрования в методе Грана (рис. 2, в) строится в координатах: ∆V / ∆Е -VT. Точка эквивалентности находится на пересечении двух прямых линий. Этой кривой удобно пользоваться для определения точки эквивалентности при титровании разбавленных растворов. Метод потенциометрического титрования более точен, чем ионометрия. Его возможности существенно расширились с разработкой новых ионоселективных электродов как индикаторных. Метод применяют при анализе мутных, загрязненных и окрашенных растворов в смешанных и неводных растворителях.
Все методы потенциометрии могут быть легко автоматизированы. Промышленность выпускает ряд автоматических потенциометрических титраторов как лабораторного, так и промышленного назначений.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 13419; Нарушение авторских прав?; Мы поможем в написании вашей работы!