
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обучающие задачи и упражнения
Занятие № 6
ТЕМА: Химия биогенных элементов. Элементы S - блока.
ЦЕЛЬ: Изучить химические свойства и биологическую роль макро- и микроэлементов.
Теоретические вопросы:
1. Биогенные элементы. Органогенные элементы и их роль в живой клетке. Металлы жизни.
2. Классификация химических элементов в организме по В.И. Вернадскому. Роль макро- и микроэлементов в живом организме. Концентрирование химических элементов в органах, тканях и биожидкостях человека. Эндемические заболевания.
3. Общая характеристика S- элементов. Валентные электроны. Изменение активности S-элементов в группе. Степень окисления. Щелочные металлы, их химические свойства. Особенности свойств лития. Оксиды, пероксиды, надпероксиды щелочных металлов. Биологическая роль натрия и калия. Натрий-калиевый насос. Соединения щелочных металлов, применяемых в медицине (NaCl, Li2CO3, NaHCO3, KCl, Na2SO4·10H2O).
4. S- элементы II A группы. Степени окисления. Тип гибридизации атомных орбиталей. Щелочноземельные элементы. Особенности свойств бериллия. Оксид и гидроксид кальция. Пероксид бария, сульфат бария. Их применение. Биологическая роль ионов магния и кальция. Антагонизм ионов магния и кальция. Соединения магния и кальция, применяемые в медицине (MgO, MgSO4, CaO, CaCl2, CaSO4·2H2O).
Задание № 1. Укажите биологическую роль внутриклеточного кальция магния.
Ответ: Клетка не может существовать без катионов Са2+ и Mg2+, которые играют чрезвычайно важную роль в регуляции ряда жизненно важных процессов в организме. Mg2+ - внутриклеточный ион, который находится в цитоплазме преимущественно в связанном состоянии с АТФ, фосфолипидами, нуклеиновыми кислотами. Mg2+ - эссенциальный элемент, участвующий в активации практически всех ферментов и метаболических процессов, как антагонист Са2+ необходим для передачи нервных импульсов и мышечных сокращений. Ионы Са2+ находятся в основном вне клетки, в цитоплазме его концентрация меньше в 10000 раз. Градиент комнцентрации ионов с разных сторон мембраны клеток обеспечивает возникновение мембранного потенциала (60-80 мВ). Внутриклеточный Ca2+ участвует в передаче регуляторных сигналов (вместе с ацетилхолином). Необходимо обеспечение гомеостаза внутриклеточного кальция, поскольку повышение его уровня приводит к гибели клеток. Для поддержания низкой концентрации используют препараты, называемые антагонистамии кальция, которые применяют для лечения гипертонии, профилактики гипертрофии сердечной мышцы, развития сердечной недостаточности, нарушений ритма, защиты почек. К числу антагонистов кальция относят, в частности производные 1,4-дигидропиридина (нифедипин), которые специфически связываются с рецептором и блокирует кальциевые каналы, ограничивая поступление катионов Ca2+ внутрь клетки.

Соединения, способные химически связывать Ca2+ чрезвычайно токсичны, например 2,2/-дипиридил. Ниже приведена реакция катионов Ca2+ с (2,2/-дипиридилом).

Задача № 1. Разбавленные растворы KMnO4, пероксида водорода H2O2 используются в медицинекак окислители исключительно наружно, поскольку при введении внутрь вызывают ожоги слизистых оболочек. Растворы KMnO4, окрашивают кожу и используемую посуду в коричневый цвет. При взаимодействии KMnO4, с H2O2 в кислой среде окраска исчезает, при этом выделяется атомарный кислород, который, как и указанные растворы, обладает бактерицидным действием. Атомарный кислород образует молекулу O2. Рассчитайте объём О2 (н.у.), который выделится при реакции 1,58 г KMnO4 с избытком раствора пероксида водорода и уксусной кислоты.
Решение:
2 KMnO4 +5 H2O2 +6 CH3COOH = 2 Mn(CH3COO)2 +5 O2↑ +2 CH3COOK
+ 8 H2O
Ионы Mn2+ менее токсичны по сравнению с ионами MnO4-.
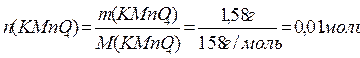

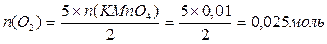

Ответ: V(O2) = 0,56 л
Упражнения для самостоятельного выполнения:
1. Бромид калия используется в медицине как успокаивающее средство. Опишите аналитические эффекты, которые будут наблюдаться при добавлении к этому веществу:
a) нитрата серебра
b) перманганата калия в кислой среде
Напишите уравнения химических реакций.
2. Укажите применение в медицине:
Na2SO4∙´ 10H2O, растворов NaCl, NaHCO3, Na2B4O7, KBr, KCl, CaCl2, суспензий MgO,
MgSO4×7H2O, CaSO4, BaSO4.
3. Запишите уравнения гидролиза карбоната и гидрокарбоната натрия, укажите рН раствора. Почему раствор гидрокарбоната натрия используется для полоскания горла при воспалении?
4. Уравняйте следующие окислительно-восстановительные реакции:
NaI + H2SO4 ® Na2SO4 + I2 +H2S +H2O
NaClO3 +NaCl + H2SO4 ® NaHSO4 + Cl2 + H2O
K2S + K2Cr2O7 + H2SO4 ® S + Cr2(SO4)3 + K2SO4 + H2O
5. В чём заключаются функции кальция в организме? Почему магний считается эссенциальным элементом.
6. В хирургической практике применяется раствор пероксида водорода с массовой долей 3%. Сколько надо миллилитров раствора пероксида водорода с массовой долей 26% (r =1,1г/мл), для приготовления 500 мл 3% раствора (r = 1,05 г/мл)?
Ответ: 55 мл
7. При некоторых заболеваниях в организм вводят раствор хлорида натрия с массовой долей 0,9%, называемый физиологическим. Вычислите сколько воды и соли нужно для приготовления 1 литра физиологического раствора, плотность которого 1,005 г/мл.
Ответ: 9,04г NaCl и 996г воды
8. Для нейтрализации щелочи, попавшей на кожу, применяется раствор борной кислоты с массовой долей 2%. Сколько насыщенного раствора борной кислоты, массовой долей 4,7%, понадобиться для приготовления 0,5л раствора с массовой долей 2%? Плотность принять равной 1 г/мл.
Ответ: 212,8 мл
9. В медицинской практике для промывания ран и полоскания горла применяется 0,5% раствор перманганата калия. Сколько граммов раствора, полученного растворением 6,4г этой соли в 100г воды и чистой воды необходимо для приготовления 1л 0,5% раствора? Плотность можно принять равной 1г/мл.
Ответ: 83,3г и 916,7мл Н2О
10.Перманганатом калия можно лечить змеиные укусы при отсутствии специальной сыворотки. Ддя этого в место укуса вводят шприцем 0,5-1,0 мл 1%-ного раствора KMnO4. Рассчитайте массу перманганата калия и объём воды, необходимый для приготовления 75 мл такого раствора, имеющего плотность 1,006 г/мл.
Ответ: m(KMnO4)=0.754г, V(H2O)=75мл
Дата добавления: 2014-01-04; Просмотров: 712; Нарушение авторских прав?; Мы поможем в написании вашей работы!