
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость химической реакции. Гомогенные и гетерогенные реакции
|
|
|
|
Гомогенные и гетерогенные реакции
Химическая реакция, протекающая в пределах одной фазы, называется гомогенной химической реакцией. Примером гомогенных реакций может служить любая реакция в растворе.
Химическая реакция, протекающая на границе раздела фаз, называется гетерогенной химической реакцией. Примером гетерогенной реакции может служить любая из реакций, идущих на поверхности твердого катализатора (гетерогенная каталитическая реакция).
Важнейшей количественной характеристикой процесса химического превращения является скорость процесса. Понятие скорости должно характеризовать количество вещества, вступившего в реакцию в единицу времени. Такое определение, однако, не может быть однозначно, так как в реакции принимают участие в качестве исходных и промежуточных веществ и в качестве продуктов реакции несколько веществ. Поэтому строго можно говорить не о скорости химического процесса вообще, а о скорости по некоторому компоненту. Изменение количества этого компонента принято выражать числом моль. Таким образом, для гомофазного химического процесса, идущего при постоянном объеме, скоростью процесса по некоторому веществу называется изменение концентрации этого вещества в единицу времени.
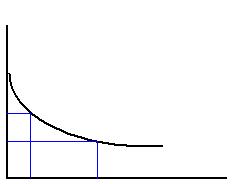
t1 t2
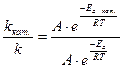 Пусть концентрация одного из реагирующих веществ в момент времени t1 равна С1, а в момент времени t2 равна С2. Тогда средняя скорость реакции
Пусть концентрация одного из реагирующих веществ в момент времени t1 равна С1, а в момент времени t2 равна С2. Тогда средняя скорость реакции за промежуток времени t2–t1 равна:
за промежуток времени t2–t1 равна:
 (1)
(1)
Но концентрация исходного вещества в процессе реакции постепенно убывает, значит (С2< С1) и разность С2 – С1 имеет отрицательный знак, т.е. С2 – С1 = –DC. Отсюда средняя скорость:
V = 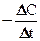 , (2)
, (2) 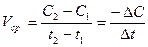
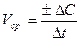
где знак минус означает, что концентрация исходного вещества убывает по времени и, следовательно, скорость реакции уменьшается. Отношение 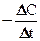 в пределе, переходя к бесконечно малым величинам, дает производную
в пределе, переходя к бесконечно малым величинам, дает производную 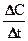 :
:
|
|
|
–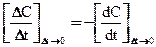 (3)
(3) 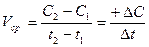
Таким образом, производная от концентрации по времени характеризует мгновенную (истинную) скорость химической реакции:
V = 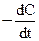 (4)
(4)
Скорость химической реакции всегда является величиной положительной, отношение же  может иметь и положительное и отрицательное значение в зависимости от того, представляет ли С концентрацию одного из исходных веществ или одного из продуктов реакции. В первом случае
может иметь и положительное и отрицательное значение в зависимости от того, представляет ли С концентрацию одного из исходных веществ или одного из продуктов реакции. В первом случае 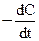 <0, но так как скорость должна быть величиной положительной, перед производной ставят знак минус; во втором случае
<0, но так как скорость должна быть величиной положительной, перед производной ставят знак минус; во втором случае 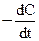 >0 и чтобы скорость реакции имела положительное значение берут производную со знаком плюс. В общем случае кинетическое уравнение имеет вид: V = lim
>0 и чтобы скорость реакции имела положительное значение берут производную со знаком плюс. В общем случае кинетическое уравнение имеет вид: V = lim 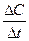 =
=  .
. 
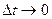
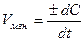
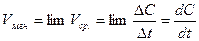
Dt®0
V =  .
.
При этом безразлично, концентрацию какого из участников реакции выбрать для измерения ее скорости, так как один из них исчезают, а другие образуются в эквивалентных количествах. Однако измеренные по разным веществам скорости не равны, а пропорциональны одна другой. Например, в реакции синтеза аммиака N2+3H2⇄2NH3 на каждый исчезающий моль N2 расходуется три моль Н2 и образуется два моль NH3. Соответствующие им скорости реакции, очевидно, относятся, как 1:3:2. 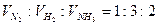
Из определения скорости реакции следует, что она имеет размерность: [концентрация]×[время]–1. В химической кинетике концентрацию чаще всего выражают в моль/л, а время – в секундах. Отсюда скорость химической реакции выражается в моль×л–1×с–1.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 717; Нарушение авторских прав?; Мы поможем в написании вашей работы!