
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Факторы, влияющие на скорость
|
|
|
|
Порядок реакции и константа скорости реакции.

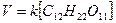
Скорость химической реакции зависит от целого ряда факторов. При заданных внешних условиях (температура, давление, среда, в которой происходит процесс) скорость является функцией концентраций реагирующих веществ. Зависимость скорости реакции от концентраций реагирующих веществ описывается основным постулатом химической кинетики: скорость реакции в каждый момент времени пропорциональна произведению концентраций реагирующих веществ, возведенных в некоторые степени. Этот постулат вытекает из физически очевидного предположения о том, что реагируют те молекулы, которые сталкиваются. Как известно, число столкновений зависит от концентрации молекул, поэтому и скорость химической реакции должна определяться теми же факторами. Итак, для реакции А+В®С+Д можно записать:
V=k[A]m ×[B]n, (6)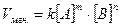
где величину m принято называть порядком реакции по веществу А, а n порядком реакции по веществу В и т.д. 


Сумму порядков реакции по всем реагирующим веществам (m+n) называют порядком реакции. Для простых реакций, протекающих в одну стадию, когда стехиометрическое уравнение отражает истинный ход процесса, показатели степени в кинетическом уравнении скорости реакции представляют собой стехиометрические коэффициенты. Например, скорость реакции
NO2 + NO2 ® N2O4 согласно опытным данным может быть записана следующим образом V = k [NO2]× [NO2] = k [NO2]2, где порядок реакции в целом равен 1 + 1 = 2. 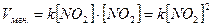
В этом случае стехиометрическое уравнение правильно отображает элементарный акт реакции. Для простых (одностадийных) реакций, как упоминалось ранее, показатели степеней в кинетических уравнениях равны коэффициентам в стехиометрических уравнениях. Эта закономерность находит свое отражение в законе действующих масс, сформулированном в 1867 году норвежскими учеными К.Гульдбергом и П.Вааге: скорость простой реакции в каждый момент времени пропорциональна произведению концентраций реагирующих веществ, имеющихся в данный момент времени, возведенных в степени, равные коэффициентам в стехиометрическом уравнении.
Таким образом, закон действующих масс является частным случаем основного постулата химической кинетики. Закон действующих масс является справедливым только для простых реакций.
В случае же сложных реакций, протекающих через несколько стадий, когда общее стехиометрическое уравнение не отражает действительного хода реакции, показатели степени в уравнении скорости реакции не будут соответствовать стехиометрическим коэффициентам.
Следует подчеркнуть, что величины m и n определяются только экспериментальным путем, так как для подавляющего большинства реакций порядки реакции по веществу не равнозначны стехиометрическим коэффициентам. Например, рассмотрим реакцию
А + В ® С + Д
 Большой избыток
Большой избыток
При большом избытке вещества В изменением его концентрации можно пренебречь, тогда скорость реакции определяется только концентрацией вещества А. И порядок реакции определяется по веществу А следующим образом: [A] ® V
 2[A] ® 4V m = 2
2[A] ® 4V m = 2
3[A] ® 9V
4[A] ® 16V
Аналогично, порядок реакции по веществу В определяется при большом избытке вещества А:
 А + В ® С + Д
А + В ® С + Д
Большой избыток
 [В] ® V
[В] ® V
2[В] ® 2V n = 1
3[В] ® 3V
4[В] ® 4V
Vмгн. = k [A]2 ×[B]1 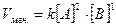
Порядок реакции играет существенную роль при изучении механизма реакции. Он в значительной степени зависит от механизма процесса. Поэтому факторы, влияющие на механизм процесса (температура, катализатор, концентрация веществ), могут влиять и на величину порядка реакции. Как было уже указано, порядок реакции определяется опытным путем и его нельзя предсказать заранее.
Порядок реакций – величина формальная. Он может быть положительным или отрицательным, целым или дробным, а также нулевым числом.
Классификация реакций по порядку
Множитель k в уравнении (6), показывающий, с какой скоростью идет химический процесс при концентрациях реагирующих веществ, равных 1 моль/л, называется константой скорости химического процесса. Она не зависит от концентрации и характеризует влияние природы реагирующих веществ на скорость их взаимодействия друг с другом. Из этого следует, что константа скорости реакции является мерой реакционной способности молекул.
Размерности констант скорости реакции различного порядка легко получить из выражения для скорости реакции:
нулевой порядок V = 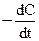 = k0, где k0 = [C]× [t]–1
= k0, где k0 = [C]× [t]–1 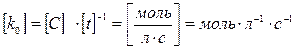
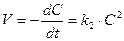 (7)
(7)
первый порядок V = 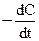 = k1C, где k1 = [t]–1
= k1C, где k1 = [t]–1 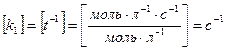 (8)
(8)
второй порядок V = 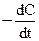 = k2C2, где k2 = [C]–1× [t]–1
= k2C2, где k2 = [C]–1× [t]–1 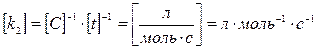 (9)
(9)
Константы скорости реакций разных порядков имеют разные размерности, и поэтому их сравнение не имеет смысла. Скорости же реакций разного порядка имеют одну и ту же размерность, а поэтому их можно сопоставить. 
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 392; Нарушение авторских прав?; Мы поможем в написании вашей работы!