
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Внутрішня енергія системи
|
|
|
|
Внутрішня енергія тіла – це сума кінетичної енергії руху молекул, потенціальної енергії їх взаємодії і внутрішньомолекулярної енергії:
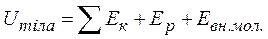 (2.1)
(2.1)
Внутрішня енергія системи дорівнює сумі внутрішніх енергій всіх тіл системи і потенціальної енергії взаємодії між ними:
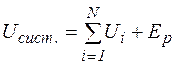 . (2.2)
. (2.2)
Внутрішня енергія системи є функцією стану. Це означає, що будь-який раз, коли система опиняється у даному стані, її внутрішня енергія приймає тільки одне притаманне цьому стану значення.
При переході системи з одного стану в інший зміна внутрішньої енергії дорівнює різниці її значень у цих станах, незалежно від шляху переходу:
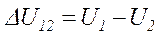 . (2.3)
. (2.3)
Внутрішню енергію системи можна змінити двома процесами і виконанням над системою роботи A¢ і наданням їй кількості теплоти Q:
 . (2.4)
. (2.4)
Вводячи 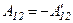 – роботу системи над зовнішніми тілами, отримаємо вираз для першого закону термодинаміки.
– роботу системи над зовнішніми тілами, отримаємо вираз для першого закону термодинаміки.
Перший закон термодинаміки:
Q = (U2 – U1) + A. (2.5)
Кількість теплоти, що надається системі, йде на приріст її внутрішньої енергії і на виконання роботи системою над зовнішніми тілами.
Для визначення величин A і Q доводиться розбивати весь процес на послідовність елементарних процесів, що відповідають невеликій зміні параметрів системи. Для елементарного процесу 1-й закон термодинаміки має вигляд
D Q =D U + D A, (2.6)
де D Q – елементарна кількість теплоти; D A – елементарна робота; D U – приріст внутрішньої енергії.
Робота при зміні об’єму. При ізобарному (p=const) процесі робота зі зміни об’єму газу визначається формулою
A12=p (V1 – V2), (2.7)
де p – тиск газу; V1 і V2 – початковий і кінцевий об’єми.
Якщо тиск газу змінюється у процесі виконання роботи, то всю зміну об’єму слід розбити на такі елементарні зміни D Vi, для яких тиск pi можна вважати незмінним. Тоді для елементарних процесів можна скористатися формулою (2.7) і записати повну роботу у вигляді
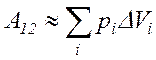 . (2.8)
. (2.8)
Строгий знак рівності можна поставити тільки під знаком границі при 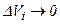 . У результаті отримаємо.
. У результаті отримаємо.
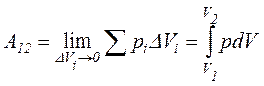 . (2.9)
. (2.9)
Тобто щоб визначити роботу системи при зміні об’єму, потрібно тиск проінтегрувати за об’ємом від початкового V1 до кінцевого V2 значень.
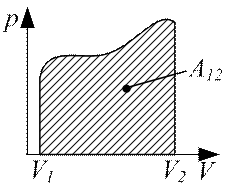
Рис. 14
На координатній площині (p, V) робота дорівнює площі криволінійної трапеції, яка зверху обмежена графіком залежності p = f (V), знизу – віссю V, ліворуч і праворуч прямими V = V1 і V = V2 (див. рис. 14).
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1566; Нарушение авторских прав?; Мы поможем в написании вашей работы!